
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
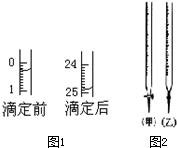 某研究性学习小组的同学用标准浓度的烧碱溶液测定未知浓度的盐酸.
某研究性学习小组的同学用标准浓度的烧碱溶液测定未知浓度的盐酸.查看答案和解析>>
科目:高中化学 来源: 题型:
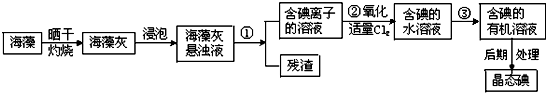
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
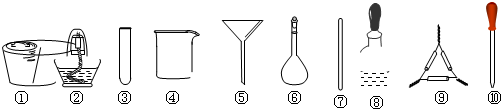
| A、将茶叶灼烧灰化,选用①、② |
| B、用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C、过滤得到的滤液,选用④、⑤ |
| D、检验滤液中的Fe3+,选用③、⑧、⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
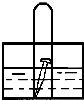 如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:
如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com