
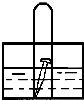
 如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:
如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:

科目:高中化学 来源: 题型:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、K+、HCO3-、Na+ |
| B、Fe3+、Cl-、H+、NO3- |
| C、Mg2+、Na+、NO3-、Cl- |
| D、K+、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水中的次氯酸具有杀菌消毒作用 |
| B、陶瓷的主要成分是碳酸钙 |
| C、硅是制造太阳能电池的常用材料 |
| D、漂白粉的有效成分是次氯酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mn |
| B、Mn2+ |
| C、Mn2O3 |
| D、K2MnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
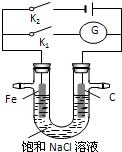
| A、K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B、K1闭合,石墨棒周围溶液pH逐渐升高 |
| C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D、K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、②③④ |
| C、③④⑤ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1mol H2O和1mol H2的体积都约为22.4L |
| B、1molNa2CO3 中Na+ 的物质的量为1mol |
| C、1mol某气体的体积为22.4L |
| D、标准状况下,1g H2和 11.2LO2的物质的量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com