
| A、Ca2+、K+、HCO3-、Na+ |
| B、Fe3+、Cl-、H+、NO3- |
| C、Mg2+、Na+、NO3-、Cl- |
| D、K+、OH-、Cl-、SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
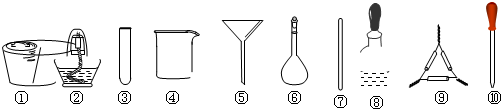
| A、将茶叶灼烧灰化,选用①、② |
| B、用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C、过滤得到的滤液,选用④、⑤ |
| D、检验滤液中的Fe3+,选用③、⑧、⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O是白色固体,Na2O2是淡黄色固体 |
| B、两物质都是碱性氧化物,其中氧元素的化合价都是-2价 |
| C、两者都能和水、二氧化碳、盐酸发生反应 |
| D、Na2O2比Na2O稳定,Na2O在一定条件下可转化为Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol?L-1NaHCO3溶液中:Ca2+、Fe3+、NO3-、Cl- |
| B、pH=1的溶液中:K+、Mg2+、SO32-、NO3- |
| C、由水电离出的c(H+)=1.0×10-13 mol?L-1溶液中:Mg2+、Na+、SO42-、Br- |
| D、c(NH3?H2O)=1 mol?L-1的溶液中:NH4+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | SiO2 | 氢氟酸 |
| ② | O2 | N2 | H2 |
| ③ | 双氧水 | SO2 | BaCl2溶液 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、①③ | B、①④ | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
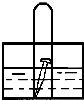 如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:
如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、2346 kJ |
| B、2670 kJ |
| C、1698kJ |
| D、2063 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com