
【题目】如图所示分别为氯化钠、氯化铯、氟化钙的晶胞模型,请认真观察后完成表格。___________

离子晶体 | 晶体结构粒子 | 晶胞所含粒子数 | 配位数 | 阴阳离子个数之比 | ||
阴离子 | 阳离子 | 阴离子 | 阳离子 | |||
氯化钠 | ||||||
氯化铯 | ||||||
氟化钙 | ||||||
【答案】
离子晶体 | 晶体结构粒子 | 晶胞所含粒子数 | 配位数 | 阴阳离子个数之比 | ||
阴离子 | 阳离子 | 阴离子 | 阳离子 | |||
氯化钠 | Na+、Cl- | 4 | 4 | 6 | 6 | 1:1 |
氯化铯 | Cs+、Cl- | 1 | 1 | 8 | 8 | 1:1 |
氟化钙 | Ca2+、F- | 4 | 8 | 8 | 4 | 2:1 |
【解析】
(1)在NaCl晶胞中,晶体结构粒子为:Na+、Cl-,由均难法:晶胞中Na+个数为:8×![]() +6×
+6×![]() =4,晶胞中Cl-个数为:12×
=4,晶胞中Cl-个数为:12×![]() +1=4;配位数是晶格中与某一原子相距最近的原子个数。每个钠离子周围有六个氯离子,每个氯离子周围也有六个钠离子,配位数均为6,阴阳离子个数之比:4:4=1:1;
+1=4;配位数是晶格中与某一原子相距最近的原子个数。每个钠离子周围有六个氯离子,每个氯离子周围也有六个钠离子,配位数均为6,阴阳离子个数之比:4:4=1:1;
(2)在CsCl晶胞中,晶体结构粒子为:Cs+、Cl-,由均难法:晶胞中Cs+个数为:8×![]() =1,晶胞中Cl-个数为:1;配位数是晶格中与某一原子相距最近的原子个数。每个Cs+离子周围有8个氯离子,每个氯离子周围也有8个Cs+离子,配位数均为8,阴阳离子个数之比:1:1;
=1,晶胞中Cl-个数为:1;配位数是晶格中与某一原子相距最近的原子个数。每个Cs+离子周围有8个氯离子,每个氯离子周围也有8个Cs+离子,配位数均为8,阴阳离子个数之比:1:1;
(3)在CaF2晶胞中,晶体结构粒子为:Ca2+、F-,F-填充在八个小立方体中心,8个四面体全被占据,由均难法:晶胞中Ca2+个数为:8×![]() +6×
+6×![]() =4,晶胞中F-个数为:8;配位数是晶格中与某一原子相距最近的原子个数。每个Ca2+离子周围有8个F-离子,配位数为8,每个F-离子周围也有4个Ca2+离子,配位数为4,阴阳离子个数之比:8:4=2:1;
=4,晶胞中F-个数为:8;配位数是晶格中与某一原子相距最近的原子个数。每个Ca2+离子周围有8个F-离子,配位数为8,每个F-离子周围也有4个Ca2+离子,配位数为4,阴阳离子个数之比:8:4=2:1;
故答案为:
离子晶体 | 晶体结构粒子 | 晶胞所含粒子数 | 配位数 | 阴阳离子个数之比 | ||
阴离子 | 阳离子 | 阴离子 | 阳离子 | |||
氯化钠 | Na+、Cl- | 4 | 4 | 6 | 6 | 1:1 |
氯化铯 | Cs+、Cl- | 1 | 1 | 8 | 8 | 1:1 |
氟化钙 | Ca2+、F- | 4 | 8 | 8 | 4 | 2:1 |


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH→CH3COO+CH3CH2O+H2O
B. 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
D. 乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH![]() CH3COO+ Cu2O↓+3H2O
CH3COO+ Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.根据所学知识回答下列问题:
(1)铁原子价电子轨道表示式为______,与铁同周期的元素的基态原子中,最外层电子数与铁相同的元素共有_____种(包含铁)。
(2)下列关于铁的说法,不正确的是_____(填选项字母)
A.基态铁原子的电子排布式1s22s22p63s23p103d24s2违反了泡利原理
B.铁属于黑色金属,在周期表中属于ds区元素
C.铁丝可用于焰色反应实验时蘸取待测物,是由于铁在光谱图中无特征的谱线
D.Fe能与CO形成配合物Fe(CO)5,配体CO中C是配原子
(3)某铁的化合物结构简式如图所示。

①组成上述化合物中5种元素原子电负性由小到大的顺序为_____。
②上述化合物中氮原子的杂化方式有_____。
③在图中用“→”标出亚铁离子的配位键_____。
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是后者,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ.甲方案
实验原理:![]()
实验步骤:

(1)判断![]() 沉淀完全的操作为____________。
沉淀完全的操作为____________。
(2)步骤②判断沉淀是否洗净所选用的试剂为_____________。
(3)步骤③灼烧时盛装样品的仪器名称为__________。
(4)固体质量为wg,则c(CuSO4)=________molL-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)_________(填“偏高”、“偏低”或“无影响”)。
Ⅱ.乙方案
实验原理:![]() ,
,![]()

实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为___________。
(7)步骤⑥需保证体系恢复到室温的原因是________(填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下![]() ,则c(CuSO4)______molL-1(列出计算表达式)。
,则c(CuSO4)______molL-1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)________(填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:_________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
A.  在NaCl晶体中,距Na+最近的Cl-形成正八面体
在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.  在CaF2晶体中,每个晶胞平均占有4个Ca2+
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.  在金刚石晶体中,碳原子与碳碳键数目比为1∶2
在金刚石晶体中,碳原子与碳碳键数目比为1∶2
D.  由E原子和F原子构成的气态团簇分子的分子式为EF或FE
由E原子和F原子构成的气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式 ;
(2)浓硫酸的作用是: ;
(3)饱和碳酸钠溶液的主要作用是___ 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是________________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
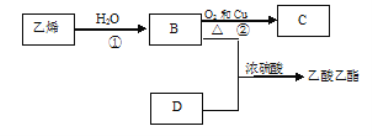
(1)乙烯的结构简式为:______________
(2)写出化合物官能团的化学式及名称:
①B中含官能团_________名称________;
②D中含官能团__________名称_________;
(3)写出反应的化学方程式
①__________反应类型:___________
②__________反应类型:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气(Cl2)是高中化学一种非常重要的气体单质,它是制备许多化工产品的原料。
Ⅰ.甲同学在实验室用体积比为1:3的氯气和空气(不参与反应)的混合气体与潮湿的碳酸钠反应来制备Cl2O,其实验装置如图所示。

已知:Cl2O熔点为-120.6℃,沸点为2.0℃,常温常压下为一种棕黄色气体。
(1)仪器B的名称为________,KMnO4与浓盐酸反应生成Cl2的离子方程式为________。
(2)装置C的作用为________,装置E中的现象是________。
(3)氯气与潮湿的碳酸钠制Cl2O的化学方程式为________。
Ⅱ.乙同学在实验室用Cl2和熔融的S反应制备S2Cl2,其实验装置如图所示。

已知:S2Cl2熔点为-76℃,沸点为138℃,常温下为橙黄色的液体,遇水易水解。
(4)W中盛放的试剂为________。
(5)乙同学应进行合理的操作顺序为________(填序号)。
a.点燃酒精灯 b.停止通氯气 c.开始通氯气 d.熄灭酒精灯
(6)检验S2Cl2和水反应的产生的气体为SO2的实验操作为________。
(7)本实验需改进的地方为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】-钒和五氧化二钒在工业中应用广泛,某工厂从钒渣(主要成分有 V2O3、FeO,还含有少量 CuO、Al2O3 等)中回收金属,工艺流程如图:
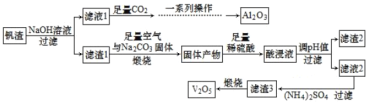
已知:①KspCu(OH)2=1.0×10-21,KspFe(OH)3=4.0×10-38 ,KspFe(OH)2=8.0×10-16
②NH4VO3 难溶于水,(VO2)2SO4 易溶于水。
(1)制取纯净的 Al2O3 需要经过“一系列操作”为过滤、___、___。
(2)滤渣 1 在“煅烧”过程中,主要成分 V2O3 转化为可溶性 NaVO3,写出其反应的化学方程式______ 。
(3)加入稀硫酸后,酸浸液中 VO![]() 与 VO
与 VO![]() 能大量共存的原因是______ (用离子方程式解释)。
能大量共存的原因是______ (用离子方程式解释)。
(4)常温下调节酸浸液的 pH=___,即可以完全除去铁、铜两种元素对应的离子; 实际 pH 值要调整到 8,其目的是______。
(5)请写出煅烧滤渣 3 时,发生反应的化学方程式 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com