
【题目】T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示. 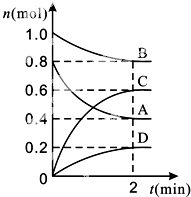
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
(1)容器中反应的化学方程式为 .
(2)前2min,v(A)=mol(minL)﹣1 .
(3)能说明该反应已达到平衡状态的是 .
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T℃时,该反应的平衡常数K=(保留小数点后两位). 反应达到平衡后,只增加B的物质的量,则平衡移动方向为;平衡常数K(填增大.减小或不变).
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是 (填选项字母).
A.只增加A的物质的量
B.移走一部分D
C.升高反应体系的温度
D.把容器的体积缩小一倍
(6)T℃时,容积为1L的密闭容器中,起始时充入0.2mol A、0.4mol B、0.3mol C、0.5mol D,此时v(正)v(逆) (填“>”“<”或“=”).
【答案】
(1)2A+B?3C+D
(2)0.4
(3)BD
(4)1.69;正向;不变
(5)C
(6)=
【解析】解:(1)A、B的物质的量减少,为反应物;C、D的物质的量增加,为生成物,达到平衡时,△n(A)=0.8mol﹣0.4mol=0.4mol,△n(B)=1mol﹣0.0mol=0.2mol,△n(C)=0.6mol,△n(D)=0.2mol,则A、B、C、D的化学计量数之比为0.4:0.2:0.6:0.2=2:1:3:1,故反应的化学方程式为:2A+B3C+D,
故答案为:2A+B3C+D;(2)前2 min,n(A)=0.8mol﹣0.4mol=0.4mol,则v(A)= ![]() =0.4mol(minL)﹣1,
=0.4mol(minL)﹣1,
故答案为:0.4;(3)A.反应前后混合气体物质的量不变,恒温恒容下,混合气体的压强始终不变,故A错误;
B.D为固体,混合气体总质量不变时,说明各组分物质的量不变,反应达到平衡状态,故B正确;
C.消耗0.1mol的B同时生成0.1mol的D,均表示正反应速率,反应始终按该比例关系进行,故C错误,
D.可逆反应得到平衡时,各组分的物质的量不变,B的物质的量不变说明反应到达平衡,故D正确,
故选:BD;(4)平衡时A为0.4mol、B为0.8mol、C为0.6mol,反应前后气体的物质的量不变,可以用物质的量代替浓度计算平衡常数,则K= ![]() =
= ![]() =1.69,
=1.69,
反应达到平衡后,只增加B的物质的量,则平衡正向移动,温度不变,化学平衡常数不变,故答案为:1.69;正向;不变;(5)A.只增加A的物质的量,平衡虽然正向移动,但A的转化率减小,故A错误;
B.D为固体,移走一部分D,不影响平衡移动,故B错误;
C.正反应为吸热反应,升高反应体系的温度,平衡正向移动,A的转化率增大,故C正确;
D.把容器的体积缩小一倍,压强增大,反应前后气体体积不变,平衡不移动,故D错误,
故选:C;(6)此时浓度商Qc= ![]() =1.69=K=1.69,故反应达到平衡状态,则v(正)=v(逆),
=1.69=K=1.69,故反应达到平衡状态,则v(正)=v(逆),
故答案为:=.
(1)A、B的物质的量减少,为反应物;C、D的物质的量增加,为生成物,达到平衡时A、B、C、D改变的物质的量分别为0.4mol、0.2mol、0.6mol、0.2mol,则A、B、C、D的化学计量数之比0.4:0.2:0.6:0.2=2:1:3:1,据此分析;(2)根据v= ![]() 计算v(A);(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;(4)反应前后气体的物质的量不变,用物质的量代替浓度代入K=
计算v(A);(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;(4)反应前后气体的物质的量不变,用物质的量代替浓度代入K= ![]() 计算平衡常数;(5)正反应为气体体积不变的吸热反应,改变条件使A的转化率增大,应使平衡正向移动,但不能只增大A的浓度,D为固体,D的物质的量变化不影响平衡移动,可以是升高温度、移走C、或增大B的浓度;(6)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
计算平衡常数;(5)正反应为气体体积不变的吸热反应,改变条件使A的转化率增大,应使平衡正向移动,但不能只增大A的浓度,D为固体,D的物质的量变化不影响平衡移动,可以是升高温度、移走C、或增大B的浓度;(6)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO![]() Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A. 该生产石墨烯的反应属于氧化还原反应
B. 石墨烯与金刚石互为同素异形体
C. Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D. 自然界中碳元素有游离态和化合态两种存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4===Cu+FeSO4 ②CaO+H2O===Ca(OH)2
③Ba(OH)2+H2SO4===BaSO4↓+2H2O ④Zn+2HCl===ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑ ⑥CaCO3
2KCl+3O2↑ ⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2 ⑧SO
2CO2 ⑧SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
(1)既是分解反应又是氧化还原反应的是_____,既是化合反应又是氧化还原反应的是______(均填序号)
(2)反应①中,氧化剂是______________________;
(3)反应③的离子反应方程式为_________________________________________
(4)写出一个符合⑧的化学反应方程式___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质分类全部正确的是
①纯碱 ②食盐水 ③石灰水 ④烧碱 ⑤液态氧 ⑥KClO3
A.碱——①④B.纯净物——③④⑤
C.盐——①⑥D.混合物——②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不能按![]() “
“![]() ” 表示反应一步完成关系转化的是
” 表示反应一步完成关系转化的是 ![]()
选项 | a | b | c |
A | SiO2 | Na2SiO3 | H2SiO3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Fe | Fe(OH)3 | Fe2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含的元素有80多种,它是一个巨大的宝藏。
(1)海水里钠的存在形式是_______。(填“游离态”或“化合态”)
(2)下列物质不经过化学变化就能从海水中获得的是_______。(填字母)
A.单质钠 B.单质钾 C.氯化钠
(3)写出钠的原子结构示意图_______。
(4)目前化学工业的主要支柱之一是氯碱工业,它是通过_____________ 来制取氯气等产品的工业,其原理用化学方程式表示为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.向某溶液中滴加KSCN 溶液,溶液呈血红色,证明存在Fe3+
B.氢氧化钠溶液保存在带橡皮塞的试剂瓶中
C.漂白粉常作环境消毒剂
D.工业上用电解饱和食盐水来制取金属钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com