
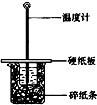
 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是固定小烧杯 |
| D、若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等 |


科目:高中化学 来源: 题型:
| 实验编号 | 样品质量 | 消耗高锰酸钾 | 测定值 | 纯度 |
| g | mL | g | % | |
| 1 | 0.0514 | 5.46 | 0.0309 | 60.04 |
| 2 | 0.0479 | 5.11 | 0.0289 | 60.30 |
| 3 | 0.0522 | 6.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
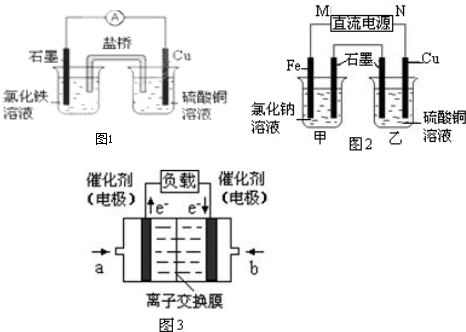
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(s)+H2(g) | K3 | ? | ? |
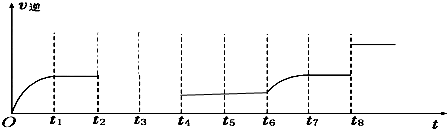
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[NO3-]>[OH-]>[NH4+]>[Ba2+] |
| B、[NO3-]>[Ba2+]>[OH-]>[NH4+] |
| C、[Ba2+]>[NO3-]>[OH-]>[NH4+] |
| D、[NO3-]>[Ba2+]>[NH4+]>[OH-] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com