
| A、[NO3-]>[OH-]>[NH4+]>[Ba2+] |
| B、[NO3-]>[Ba2+]>[OH-]>[NH4+] |
| C、[Ba2+]>[NO3-]>[OH-]>[NH4+] |
| D、[NO3-]>[Ba2+]>[NH4+]>[OH-] |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
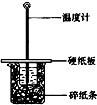 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是固定小烧杯 |
| D、若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
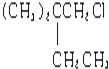 ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示:
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:
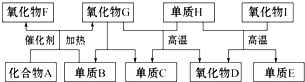
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向0.1 mol?L-1NH4 Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)<c(Cl-) |
| C、已知Ka(HF)=7.2×10-4,Ka(HCN)=4.9×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D、浓度均为0.1mol?L-l的三种溶液中:①(NH4)2CO3、②(NH4)2 SO4、③(NH4)2Fe(SO4)2,c(NH4+)的大小顺序为:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若溶液中c(OH-)=10-7 mol/L,则该溶液一定呈中性 |
| B、c(H+)越大,则pH越大,溶液的碱性越强 |
| C、pH=0的溶液,其中只含有H+,而无OH- |
| D、向25℃纯水中加少量NaHSO4(温度不变),c(H+)、c(OH-)乘积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(gO2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com