
【题目】以乙炔和乙醛为原料制备1,3-丁二烯的合成路线如图所示:下列说法不正确的是
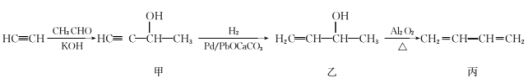
A.甲、乙两种有机化合物中均含有手性碳原子
B.CH3CHO既可被氧化为CH3CH2OH,又可被还原为CH3COOH
C.丙(1,3-丁二烯)形成的高聚物的结构简式为![]()
D.合成路线中涉及到的反应类型有加成反应和消去反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)阅读、分析下列两个材料:
材料一
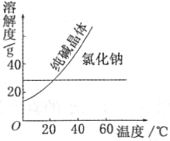
材料二
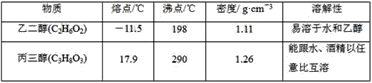
回答下列问题(填字母):
A.蒸馏法
B.萃取法
C.“溶解、结晶、过滤”的方法
D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用___;
②将乙二醇和丙三醇相互分离的最佳方法是___。
(2)阅读材料三回答下列问题:
材料三
在溶解性方面,Br2(溴)与I2(碘)很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
①常用的提取方法是___,化学试剂是___,最主要的仪器是___。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题(提示B分液漏斗中为浓氨水,滴入烧瓶可产生氨气):
(1)装置的连接顺序是:(a)接________,________接________;(b)接________

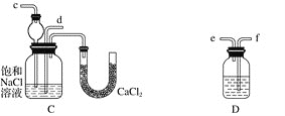
(2)A中常选用的固体反应物为______________;D中应选用的液体为________________(填化学式)。
(3)第二步骤中必须先让__________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________________,C中广口瓶内产生固体的总化学方程式为______________________ 。
(5)在第四步中分离NH4Cl晶体的操作是____________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验证明所得固体的成分中含有Na+,简要写出操作和现象____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用下列实验装置或方案能达到实验目的的是
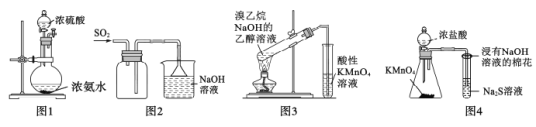
A.用图1装置制备少量氨气
B.用图2所示装置收集SO2
C.用图3所示装置检验是否有乙烯产生
D.用图4装置比较KMnO4、C12、S的氧化性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )

A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱中和滴定是中学化学常见实验。
Ⅰ.下图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL。
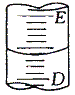
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ.某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A 冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B 量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C 将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D 将物质的量浓度为1.50 mol·L-1的标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E 继续滴定至终点,记下读数为V2。
F 在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G 量取浓硫酸样品5 mL,在烧杯中用蒸馏水溶解。
H 重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为____→ A →_____→_____→D→_____→_____→ H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是________________________;量取20.00mL稀硫酸的仪器是_________。
(3)选用的指示剂是_____________。滴定过程中,视线应注视____________________;判断到达滴定终点的现象是________________;读数时,视线应____________(填“高于”、“低于”或“相平于”)溶液凹液面的最低处。
(4)下表是实验测得的有关数据:
滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
V1 | V2 | ||
① | 20.00 | 0.50 | 22.60 |
② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为____________mol·L-1 (不必写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com