
����Ŀ����ͼ����1��18��Ԫ���в���Ԫ����ɵ�һЩ���ʼ��仯����֮���ת����ϵͼ�����³�ѹ�£�D��F��K��Ϊ��ɫ�̼�����ζ�����壬B���������ɫҺ�壬A���ɵ���C��D��ȼ�����ɵĵ���ɫ���塣����Ӧ�����ɵIJ�����������ȥ��
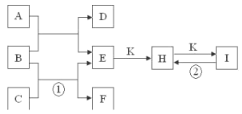
��ش��������⣺
��1������A�Ļ�ѧʽΪ_______��
��2��������E����ˮ�еĵ��뷽��ʽΪ_________________________________��
��3��ʵ���ҽ�����Cͨ��������_______�У���д����Ӧ�ٵ����ӷ���ʽ�����õ����ű������ת�Ƶķ������Ŀ_____________________________��
��4����Ӧ�ڵĻ�ѧ����ʽΪ____________________��
��5���������ֱ�װ��H��I������Լ�ƿ�����ǩ����������֡�������������ǣ������Լ����п�ѡ�õ���________.
A.����ʯ��ˮ B.ϡ���� C.���ȣ����� D.��ɫ��Ӧ
���𰸡�Na2O2 NaOH=Na++OH- ú�� 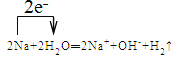 2NaHCO3
2NaHCO3![]() Na2CO3+H2O+CO2�� BC
Na2CO3+H2O+CO2�� BC
��������
A���ɵ���C��D��ȼ�����ɵĵ���ɫ���壬ӦΪNa2O2��B���������ɫҺ�壬ӦΪH2O����DΪO2����ת����ϵ��֪��EΪNaOH��CΪNa��FΪH2����ת����ϵ��֪KΪCO2��HΪNa2CO3��IΪNaHCO3���Դ˽����⡣
��1�������Ϸ�����֪AΪNa2O2���ʴ�Ϊ��Na2O2��
��2��EΪNaOH��Ϊǿ����뷽��ʽΪNaOH=Na++OH-���ʴ�Ϊ��NaOH=Na++OH-��
��3��Naһ�㱣����ú���У���Ӧ��ΪNa��H2O�ķ�Ӧ����Ӧ�����ӷ���ʽΪ2Na+2H2O=2Na++2OH-+H2�����õ����ű������ת�Ƶķ������ĿΪ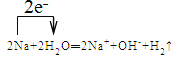 ���ʴ�Ϊ��ú�ͣ�
���ʴ�Ϊ��ú�ͣ�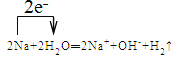 ��
��
��4����Ӧ����̼�����Ƽ��ȷֽ�����̼���ơ�������̼��ˮ����Ӧ����ʽΪ��2NaHCO3![]() Na2CO3+H2O+CO2�����ʴ�Ϊ2NaHCO3
Na2CO3+H2O+CO2�����ʴ�Ϊ2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
��5��̼���ơ�̼�����ƾ������ʯ��ˮ��Ӧ������ɫ�����������ᷴӦʱ��̼�����ƽ�Ϊ���ң���̼�����Ʋ��ȶ��������ֽ⣬�����������٣������BC���飬�ʴ�Ϊ��BC��


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��12��1�չ��ʴ�����Ӧ�û�ѧ���ϻ����������ϳɵ�������Ԫ������Ϊ113�� (��дΪNh)��115��(Mc)��117��(Ts)��118��(Og)������˵����ȷ����
A. 113��Ԫ�ص�������Ϊ����������
B. 115��Ԫ��λ�ڵ������ڵ�VA��
C. 117��Ԫ�ص�ij��ԭ�ӣ����ں�176�����ӣ���ԭ����![]() Ts
Ts
D. 118��Ԫ�ص�ԭ���������8������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У�a��b���Ƕ��Ե缫��ͨ��һ��ʱ���b��������Һ�ʺ�ɫ��������˵����ȷ���ǣ� ��

A.X��������Y�Ǹ�����CuSO4��Һ��pH��С
B..X��������Y�Ǹ�����CuSO4��Һ��pH���ֲ���
C.X�Ǹ�����Y��������CuSO4��Һ��pH ��С
D.X�Ǹ�����Y��������CuSO4��Һ��pH���ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z��M��R���ֶ���������Ԫ�أ�������Ϣ���±���ʾ��
X | Y | Z | M | R | |
ԭ�Ӱ뾶/nm | 0.074 | 0.099 | |||
��Ҫ���ϼ� | +4��-4 | -2 | -1��+7 | ||
���� | �����Ӻ������� | ���ǽ������ϵ����� | �������ڼ����Ӱ뾶��С |
��ش��������⣺
��1��Z��NaOH��Һ��Ӧ�����ӷ���ʽ��___��(��Ԫ�ط��ű�ʾ����ͬ��)
��2��������ʵ��˵��R�ǽ����Ա�Yǿ��һ���۵���___(ѡ����ĸ���)��
a.������Y�ĵ��ʳʹ�̬��R�ĵ��ʳ���̬
b.��̬�⻯���ȶ���R>Y
c.Y��R�γɵĻ�������Y������
d.Y��R�����γɵĺ�������R�������Ը�ǿ
��3�����ⶨX2M2Ϊ��Ԫ���ᣬд��X2M2�ĵ���ʽ___�������Ա�̼��Ļ�Ҫ������д�����һ������ĵ��뷽��ʽ___��
��4����֪I2����X2M2�ֽ�Ĵ�����
��һ����X2M2��I2��2XIM��
�ڶ���������
��д���ڶ�����Ӧ�Ļ�ѧ����ʽ___��
��5����ӡˢ��·���Ϻ���ͭ�������Ļ��շ����ǽ�������ʹͭת��Ϊ����ͭ�����������ܽ⡣���ڸ���X2M2��ϡ������ݷ�ӡˢ��·��ȴﵽ����Ŀ�ģ��ֱ����˻�������д����Ӧ�����ӷ���ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������;�dz��㷺��ʵ����������װ����ȡ������������ȡ������������̽��ʵ�顣�ش��������⣺
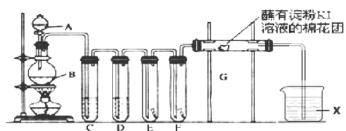
��1��A��ʢ��Ũ���ᣬB��ʢ��![]() ��д����Ӧ�����ӷ���ʽ__________________��
��д����Ӧ�����ӷ���ʽ__________________��
��2��E��Ϊ��ɫ�ɲ�����F��Ϊ��ɫʪ�������Ա�E��F�й۲�����IJ���ɵó��Ľ�����__________________��
��3���Թ�C��D���Լ����Ƹ�Ϊ_____________________��X�Լ���������______________��
��4��װ��G��������Ӧ�����ӷ���ʽΪ_____________________________��
��5����ͥ�г�������Һ����Ҫ�ɷ�![]() �������飨��Ҫ�ɷ����ᣩ���������ijƷ������Һ��װ��˵������ͼ��
�������飨��Ҫ�ɷ����ᣩ���������ijƷ������Һ��װ��˵������ͼ��

�١�������ͬʱʹ�á�������ж�������д����Ӧ�����ӷ���ʽ____________��
���衰�ܱձ��桱��ԭ��_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮɹ�κ����±�к�Br-������ȡBr2��������ͼ:
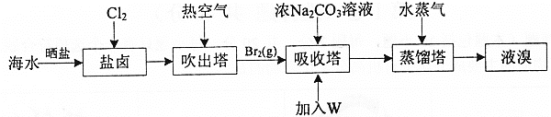
��֪:��3Br2+3CO![]() = 5Br- +BrO
= 5Br- +BrO![]() +3CO2����5Br- +BrO
+3CO2����5Br- +BrO![]() +6H+ =3Br2 +3H2O
+6H+ =3Br2 +3H2O
����˵������ȷ����
A.��ˮɹ����ʵ����Ԫ�صĸ���
B.ͨ��Cl2������Ӧ: 2Br- +Cl2= Br2 +2Cl-
C.�������м���W��Һ��õ�Br2��W����������
D.��ˮ��Br-��Ũ��ԼΪ66mg��L-1 �����ù�������ȡ��Ϊ60%��1m3��ˮ���Ƶ�39.6g Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ�����̶����ܱ������У����淴ӦH2(g)��I2(g) ![]() 2HI(g) (��ɫ)��ƽ��״̬����״̬�£�˵������ȷ����(����)
2HI(g) (��ɫ)��ƽ��״̬����״̬�£�˵������ȷ����(����)
A. ���淴Ӧֹͣ B. I2Ũ�Ȳ��ٱ仯
C. HIŨ�Ȳ��ٱ仯 D. ���������ɫ���ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��Si���γɶ��ָ�Ӳ�Ȳ��ϣ���![]() ��
��![]() ��SiC
��SiC
��1��![]() ��
��![]() ��Ӳ�Ƚϸߵ���______��������______��
��Ӳ�Ƚϸߵ���______��������______��
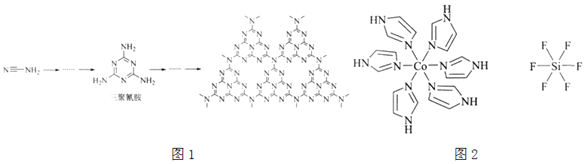
��2��![]() ��N���γ�һ����ʯī�ṹ���ϣ���ϳɹ�����ͼ1��ʾ������ʯī�ṹ���ϻ�����Ļ�ѧʽΪ______����ϳɹ������������谷�γɣ������谷��Nԭ�ӵ��ӻ���ʽ��______��
��N���γ�һ����ʯī�ṹ���ϣ���ϳɹ�����ͼ1��ʾ������ʯī�ṹ���ϻ�����Ļ�ѧʽΪ______����ϳɹ������������谷�γɣ������谷��Nԭ�ӵ��ӻ���ʽ��______��
��3��![]() ��N���γ�һ����Ԫ��״�л�������
��N���γ�һ����Ԫ��״�л�������![]() ��дΪ
��дΪ![]() ����ṹΪ
����ṹΪ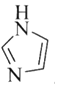
![]() ������
������![]() �Ľṹʾ��ͼ��ͼ2��
�Ľṹʾ��ͼ��ͼ2��
��������![]() ��
��![]() ֮������������Ӽ�ľ������������������������д��������ı�ʾʽ��______��
֮������������Ӽ�ľ������������������������д��������ı�ʾʽ��______��![]() ����ˮ������ı�ʾʽΪ
����ˮ������ı�ʾʽΪ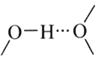
![]()
�ڶ�ԭ�ӷ����и�ԭ������ͬһƽ�棬�����ƽ�е�p�������p���ӿ��ڶ��ԭ�Ӽ��˶����γ�������![]() ��������
��������![]() �������������
�������������![]() ����
����![]() ����im�����д��ڵ�������
����im�����д��ڵ�������![]() ������______��
������______��
��4��![]() Ϊ������ϵ���壬�þ�����ԭ�ӵ��������Ϊ
Ϊ������ϵ���壬�þ�����ԭ�ӵ��������Ϊ
C��![]() ��
��![]() ��
��![]() 0��
0��![]() ��
��![]() ��
��![]() ��
��![]()
Si��![]() ��
��![]() ��
��![]() ��
��![]()
��![]() ���������к���______��Siԭ�ӡ�______��Cԭ�ӡ�
���������к���______��Siԭ�ӡ�______��Cԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6mol X�����0.6mol Y��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��2X��g��+Y��g��=nM��g��+2W��g��2min ĩ������֪��W ��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05molL��1min��1������������������ʵ����뷴Ӧǰ����������������ʵ���֮��Ϊ5��4����
��1��ǰ2min����Y��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ___________��
��2��2minĩʱX��Ũ��Ϊ_________��
��3����ѧ��Ӧ����ʽ��n��ֵ��____________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com