
����Ŀ��������Ԫ�����ڱ��IJ�ͼ������������ĸ���ŷֱ����ijһ��Ԫ�أ���ش�

(1)���е�ʵ�߱�ʾԪ�����ڱ������ұ߽磬����ʵ�߲�ȫԪ�����ڱ������±߽�__________��
(2)��������õĽ���������õķǽ����γɵ�������__________________(�ѧʽ)��
(3)��a��d����Ԫ�ؿ��γ����ֻ����д������һ�ֻ�����ֽ�������һ�ֻ�����Ļ�ѧ����ʽ��_________________________________________________________________________________�������ֻ������������Ļ�ѧ����________(����ĸ)��
A ���Թ��ۼ� B �Ǽ��Թ��ۼ� C ���Ӽ�
(4)e��f��k��m��Ӧ�ĵ�ԭ�����ӵİ뾶�ɴ�С��˳��Ϊ__________(�����ӷ���)��
(5)d��m��Ӧ�����ӻ�ԭ����ǿ����˳��Ϊ___________________________________(�����ӷ���)��
(6)d��e��m����̬�⻯���У���ȶ�����________________________(�����ʽ)��
(7)�õ���ʽ��ʾn��m�γɵ�ԭ�Ӹ�����2��1�Ļ�������γɹ��̣�__________________��
���𰸡� KF 2H2O2=2H2O��O2�� AB S2����F����Na����Al3�� S2����O2�� H2S
KF 2H2O2=2H2O��O2�� AB S2����F����Na����Al3�� S2����O2�� H2S ![]()
��������
��Ԫ�������ڱ��е�λ�ÿ�֪��aΪH��bΪC��dΪO��eΪF��fΪNa��kΪAl��mΪS��nΪK��pΪBr���ݴ˽��з�����
��1����һ��������2��Ԫ�أ��ֱ��ڵ�1��18�У�������������8��Ԫ�أ��ֱ��ڵ�1��2�У�13�е�18�У���2�����3��֮��û��Ԫ�أ���ʵ�߲�ȫԪ�����ڱ����ϱ߽�Ϊ�� ��
��
�𰸣�
��2����Ԫ�����ڱ��У�����ý��������½ǣ���Ϊ���е�K������õķǽ��������Ͻǣ���F��K��F��ɵ�������KF��
�𰸣�KF
(3)��a��d����Ԫ�ؿ��γ�H2O��H2O2��H2O2���Էֽ�����ˮ����������ѧ����ʽ��2H2O2=2H2O��O2�� ���⻯�����к���H-O��O-O��Ϊ���ۼ��еļ��Թ��ۼ��ͷǼ��Թ��ۼ���
�𰸣�2H2O2=2H2O��O2�� AB
(4)�뾶�Ƚϣ���1�����Ӳ�Խ�࣬�뾶Խ��2�����Ӳ�����ͬʱ���˵����Խ������������Խǿ���뾶ԽС�����e��f��k��m��Ӧ�ĵ�ԭ�����ӵİ뾶�ɴ�С��˳��Ϊ S2����F����Na����Al3����
�𰸣� S2����F����Na����Al3��
(5)ͬһ������ϵ���Ԫ�طǽ����Լ����������ӻ�ԭ����ǿ��d��m��Ӧ�����ӻ�ԭ����ǿ����˳��ΪS2����O2����
�𰸣�S2����O2��
(6)�ǽ�����Խǿ����̬�⻯��Խ�ȶ���d��O����e��F����m��S���У�S�ķǽ���������������̬�⻯����H2S��ȶ���
�𰸣�H2S
(7)��ΪK������ǿ����ʧ���ӣ�S�ǽ����Խ�ǿ���õ��ӣ����K��S�γɵ�ԭ�Ӹ�����2��1�Ļ�����Ϊ���ӻ�����γɹ���Ϊ![]() ��
��
�𰸣�H2S ![]()



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ��۲���ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��A1C13��Һ����ε���NaOH�� Һ��������Ȼ��ͨ��CO2���� | �ȳ��ְ�ɫ�������������ʧ������ֳ��ְ�ɫ���� | Al(OH)3��������������������ܽ���ijЩ������ |
B | ��Ũ�Ⱦ�Ϊ0.1mol/L��MgCl2�� CuCl2�����Һ����μ��백ˮ | �ȳ�����ɫ���� | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | ��Na2CO 3��Һ�м���Ũ������������������ͨ���������Һ�� | ������ɫ���� | ���ԣ�����>̼��>���� |
D | ��ʢ��KI3��Һ�����Թ��зֱ���������Һ��AgNO3��Һ | ǰ����Һ����ɫ�������л�ɫ���� | KI3��Һ�д���I3- |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Sr3N2)�ڹ�ҵ���й㷺��Ӧ�ã�ijѧϰ��ȤС���������������ʵ�鷽���Ʊ�����������֪�����뵪���ڼ��������·�Ӧ���������ȣ���������ˮ���ҷ�Ӧ�����������ȺͰ�����������������װ���Ʊ������ȡ�

�ش���������:
(1)Sr��Ԫ�����ڱ��е�λ����____________________
(2)д��Aװ���б����Ȼ����Һ��NaNO2��Һ��Ӧ�Ļ�ѧ����ʽ__________________________
(3)����������д��װ�õ�����˳��Ϊ___________(װ�ÿ��ظ�ʹ�ã�����ĸ��ʾ)��
(4)ʵ��ʱ�ȵ�ȼ_____���ƾ���(����A������B��)��һ��ʱ���ȼ��һֻ�ƾ��ơ�

������ij������Ʒ���ܺ���������CO��CO2��O2���������ʣ�ijͬѧ�������װ���Ʊ�������(��װ��ʢװ�����Լ�)����֪:�����������ͭCH3COO[Cu(NH3)2]��Һ�ܶ�������CO�����ױ�O2������ʧȥ����CO�������������Ӽ�����Һ�ܶ�������O2��
(5)�Թܢ�ʢװ���Լ���_____________________(д�Լ�������)��
(6)�ⶨ��Ʒ���ȣ�ȡXg��Ʒ,�����м���������ˮ��������������ȫ��ͨ�뵽Ũ�����У�Ũ��������mg�����Ʒ����Ϊ______(�ô���ʽ��ʾ)��
(7)��ͬѧ��Ϊ��������ʹ��ò�Ʒ����ƫ�ߣ���ԭ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������·���ѩ�����dz�ʹ��һ����ѩ��������Ҫ�ɷֵĻ�ѧʽΪXY2��X��Y��Ϊ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ����1 mol XY2����54mol���ӡ�
��1������ѩ���Ļ�ѧʽ��____���������л�ѧ��������______������ʽ��______��
��2��Ԫ��D��Eԭ�ӵ�����������������Ӳ�����2����D��Y���ڣ���D�����ӽṹʾ��ͼ��__________��D��E���γ�һ�ֽṹ������CO2����ԭ�ӷ��ӣ���ÿ��ԭ�Ӿ��ﵽ��8e���ȶ��ṹ���÷��ӵĽṹʽΪ_________������ʽΪ_______����ѧ������Ϊ_________(����Ӽ������Ǽ��Թ��ۼ������Թ��ۼ���)��
��3��W����Dͬ����Ķ�����Ԫ�أ�Z�ǵ������ڽ�������ǿ��Ԫ�أ�Z�ĵ�����W�ij��������з�Ӧʱ�����ֲ��������ʱ����____���仯ѧ������Ϊ___������ʱ����_____���仯ѧ������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��b��d�������л��ϳ��Ʊ��ľ�������ṹ���л��p��m�ǹ㷺�����ڶ�ֲ����������������˵����ȷ����

A. b��d��Ϊͬ���칹�壬p��m��Ϊͬ���칹��
B. b��d��p�У�ֻ��p������̼ԭ����ͬһ��ƽ����
C. d��p��m���������Ը��������Һ��Ӧ
D. b�Ķ��ȴ��������֣�d��H2�ӳɺ�IJ����һ�ȴ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������0.2gͭ����5mL1 molL1FeCl3��Һ��ϣ��������Һ�ػ�ɫ��dz����Һ���̣��лҰ�ɫ������֡�ͨ���������ϣ�������Ϊ�Ұ�ɫ������ܺ�CuCl(CuCl��ɫ���壬������ˮ�����ᡢϡ���ᣬ���ڰ�ˮ��Ũ������Һ�У����������)��Ϊ��һ��̽���Ұ�ɫ�����Ƿ�CuCl������һϵ��ʵ�顣��֪���� CuCl+2NH3H2O![]() [Cu(NH3)2]++Cl+2H2O(��ɫ��Һ)�� �ṩ���Լ���ϡHNO3��AgNO3��Һ����ˮ��KSCN��Һ
[Cu(NH3)2]++Cl+2H2O(��ɫ��Һ)�� �ṩ���Լ���ϡHNO3��AgNO3��Һ����ˮ��KSCN��Һ
��ش��������⣺
(1)����CuCl�Ļ�ѧ����ʽ____________________________________��
(2)����Ϊ�����ķ���װ��(װ���е�������������)����������Һ�з�����������Ӧѡ�õ���Ӧװ���е�����������_______________��
A. B.
B. 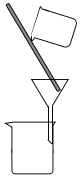 C.
C.![]() D.
D. E.
E. F.
F.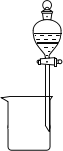
(3)�ᴿ�Ұ�ɫ���壺����������������ˮϴ���Գ�ȥ��������Fe3+��Cl��Ϊ������������Ƿ�ϴ�Ӹɾ�����ѷ����Ǽ���ϴ��Һ���Ƿ���_______(�����ӷ���)��������_____________________________________________��
(4)���ʵ�����õ��ĻҰ�ɫ�����к���CuCl����ʵ��������õ����Լ�Ϊ____________________��
(5)ʵ���ûҰ�ɫ������������Ϊa g������CuCl b g������ʵ������л���CuCl2���ɣ�������CuCl2�����ʵ�����____________(�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��������У����崵����������ʹ�����������ռ�SO2���������Դﵽ������Ŀ�ģ���ѧ��ӦΪBr2��SO2��2H2O===2HBr��H2SO4������˵����ȷ����( )��
A. Br2�ڷ�Ӧ�б��������� B. SO2�ڷ�Ӧ�б���ԭ
C. Br2�ڷ�Ӧ��ʧȥ���� D. 1 mol�������ڷ�Ӧ�еõ�1 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2017������)��ѹ���ʻ�������������ԭ��Ϊ��Ni(s)+4CO(g)![]() Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
��һ�Σ���������CO��Ӧת������̬Ni(CO)4��
�ڶ��Σ�����һ�η�Ӧ���������������������230���Ƶøߴ�����
�����ж���ȷ����
A. ����c(CO)��ƽ���������ƶ�����Ӧ��ƽ�ⳣ������
B. �ڶ��Σ�Ni(CO)4�ֽ��ʽϵ�
C. ��һ�Σ���30����50������֮��ѡ��Ӧ�¶ȣ�ѡ50��
D. �÷�Ӧ�ﵽƽ��ʱ��v����[Ni(CO)4]=4v����(CO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�H2O2��ˮ��Һ�з����ֽⷴӦ��2H2O2![]() 2H2O+O2����Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
2H2O+O2����Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
t/min | 0 | 20 | 40 | 60 | 80 |
c��H2O2��/molL��1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
�� H2O2�ķֽⷴӦ________������ԭ��Ӧ����ǡ����ǡ�����
�ڸ÷ֽⷴӦ0��20min��ƽ����Ӧ����v��H2O2��Ϊ________molL��1 min��1 ��
�������Ӧ���õ�H2O2��ҺΪ100mL������O2________g��
A��0.08 B��0.16 C��1.28 D��2.4��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com