
����Ŀ��ͭ����������ʹ�õĽ���֮һ���䵥�ʼ���������й㷺����;��
��1����̬ͭԭ�Ӻ�����________�������෴�ĵ��ӡ�
��2����ͭ��ͭ������Ǧ��Ԫ�ذ�һ�������������ɵĺϽ𡣵�һ������I1(Sn)____________I1(Pb)(����ڡ���С�ڡ�)��
��3�����Ƶ�Cu(OH)2�ܹ��ܽ���Ũ��ˮ�У���Ӧ�����ӷ���ʽ��____________________________________��
��4������ͭƬ�������Ӧ���ҹ��о���Ա����Ȳ����Ϊԭ�ϣ����������״�ͨ����ѧ�������ȫ̼���ϡ�ʯīȲ��Ĥ(�ṹƬ����ͼ��ʾ)���������˹���ѧ�ϳ�̼ͬ���������������ʯīȲ��̼ԭ��_________________________���ӻ���ʽ��

��5��CuCl��������Һ������CO�γ��Ȼ��ʻ���ͭ��I���������ڶ����ⶨ����������CO�ĺ������Ȼ��ʻ���ͭ��I���к�___________������Ŀ��
��6��Cu2O�����ڰ뵼����ϡ�
��Cu2O����(��ͼ��ʾ)�У�Oԭ�ӵ���λ��Ϊ________________��aλ��Cu+����Ϊ(0.25��0.25��0.75)����bλ��Cu+����_______________________��
��Cu2S��Cu2O�������ƾ���ṹ�������ߵ��۵���Cu2O��Cu2S��_________(��ߡ��͡�)�������ԭ��___________________��
���𰸡�14 ���� Cu(OH)2+4NH3��[Cu(NH3)4]2++2OH�� sp��sp2 14 4 (0.75��0.75��0.75) �� ���߶������Ӿ��壬O2���뾶��S2���뾶С������Cu2O�ľ����ܸ����۵����
��������
(1)CuΪ29��Ԫ�أ����ݹ���ԭ��֪���̬�����Ų�Ϊ1s22s22p63s23p63d104s1�����̬ͭԭ�Ӻ�����14�������෴�ĵ��ӣ�
(2)������Խǿ��Խ��ʧ���ӣ���һ������ԽС��Sn��PbΪͬ����Ԫ�أ��ҽ�����SnС��Pb�����һ������I1(Sn)����I1(Pb)��
(3)���Ƶ�Cu(OH)2�ܹ��ܽ���Ũ��ˮ�У����ɿ�����ˮ��[Cu(NH3)4]2+����Ӧ�����ӷ���ʽ��Cu(OH)2+4NH3��[Cu(NH3)4]2++2OH����
(4)̼̼������Cԭ�Ӽ۲���ӶԸ�����2�Ҳ����µ��Ӷԣ������ӻ���ʽΪsp�������е�̼�γ�3���������µ��Ӷԣ���ȡsp2�ӻ���
(5)���Ȼ��ʻ���ͭ(I)��C��O֮����1��������H2O��������2����������λ��Ҳ�����������Ȼ��ʻ���ͭ(I)�к�14��������
(6)��Cu2O�����У�Oԭ����Χ�����Cuԭ����Ŀ��4����Oԭ�ӵ���λ��Ϊ4��aλ��Ϊ����Oԭ�Ӻ�����Oԭ�ӵ�![]() �����Ҷ���Oԭ����a֮��ľ���Ϊ�Խ��ߵ�
�����Ҷ���Oԭ����a֮��ľ���Ϊ�Խ��ߵ�![]() ����֪aλ��Cu+����Ϊ(0.25��0.25��0.75)���������߳�Ϊ1����bλ��Cu+����Ϊ(0.75��0.75��0.75)��
����֪aλ��Cu+����Ϊ(0.25��0.25��0.75)���������߳�Ϊ1����bλ��Cu+����Ϊ(0.75��0.75��0.75)��
��Cu2S��Cu2O�������Ӿ��壬O2���뾶��S2���뾶С������Cu2O�ľ����ܸ�����Cu2O�۵���ߡ�


 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д� �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪ![]() ������˵����ȷ����
������˵����ȷ����
A. 1L0.1mol��![]() NH4Cl��Һ�У�
NH4Cl��Һ�У� ![]() ������Ϊ0.1
������Ϊ0.1![]()
B. 2.4gMg��H2SO4��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.1![]()
C. ��״���£�2.24LN2��O2�Ļ�������з�����Ϊ0.2![]()
D. 0.1mol H2��0.1mol I2���ܱ������г�ַ�Ӧ�����������Ϊ0.2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Է�������ԼΪ4000�ľ��Ҷ����������õ�ˮ���ԣ���һ�ֻ�к�������Ҷ������ɻ������������������¾ۺ϶���(![]() )������˵����ȷ����
)������˵����ȷ����
A.�������������������·����Ӿ۷�Ӧ�Ƶþ��Ҷ���
B.���Ҷ����Ľṹ��ʽΪ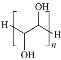
C.��Է�������ԼΪ4000�ľ��Ҷ����ľۺ϶�n��67
D.���Ҷ����ܱ��ֳ���ˮ�ֵ�ԭ������ɺ�H2O���Ӽ��γ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪT1ʱ�����ݻ�Ϊ2 L ���ܱ������ס����зֱ����һ������CO(g)��H2O(g)��������Ӧ��CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = ��41 kJ/mol���������£�����˵������ȷ����
CO2(g) + H2(g) H = ��41 kJ/mol���������£�����˵������ȷ����
���� | �� | �� | ||
��Ӧ�� | CO | H2O | CO | H2O |
��ʼʱ���ʵ�����mol�� | 1.2 | 0.6 | 2.4 | 1.2 |
ƽ��ʱ���ʵ�����mol�� | 0.8 | 0.2 | a | b |
A. �������У�ƽ��ʱ����Ӧ�ų�������Ϊ16.4 kJ
B. T1ʱ����Ӧ��ƽ�ⳣ��K�� = 1
C. ƽ��ʱ������CO��Ũ���Ǽ��е�2��
D. �������У�ƽ��ʱCO��ת����ԼΪ75%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ͨ���ܶȷ��������о��״���ˮ�����������ⷴӦ����ʱ���õ��״���Pd(��)���淢������ʱ�ĸ�·�������������ϵ��ͼ��ʾ�����и���Pd(��)�����������*��ע������˵���������
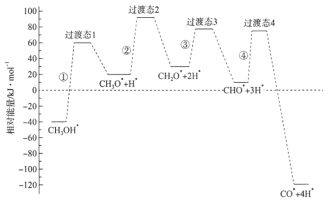
A.���а���C��H���Ķ��ѹ���
B.������������(��Ӧ���)��С���Ǣ�
C.����������Լ��Ӧ���ʵķ���ʽΪCH3O*+3H* CO*+4H*
D.�ɴ����̿�֪��![]() ��H��0
��H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ��Ϊͬ���칹�壬����˵������ȷ����
��Ϊͬ���칹�壬����˵������ȷ����
A. z�Ķ��ȴ���������
B. x��y��һ�ȴ����ֻ������
C. x��y��z��ֻ��x������ԭ�ӿ��ܴ���ͬһƽ��
D. x��y ��ʹ������Ȼ�̼��Һ�����ӳɷ�Ӧ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����һ±�����ڴ��������¿����ɱ���ͬϵ�![]() +CH3X��
+CH3X��![]() +HX���ڴ��������£��ɱ������и������ʺϳ��ұ����Ӧѡ�õ���
+HX���ڴ��������£��ɱ������и������ʺϳ��ұ����Ӧѡ�õ���
A.CH2=CH2��HClB.CH3CH3��I2
C.CH2=CH2��Cl2D.CH3CH3��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E���Ƕ�����Ԫ�أ���ԭ��������������A��Bͬ���ڣ�A��Dͬ���壬Aԭ���������������ڲ�������Ķ�����BԪ������������������������B����������C�������ӵ��Ӳ�ṹ��ͬ��C�ĵ�����B�ĵ����ڲ�ͬ�����·�Ӧ��������C2B��C2B2��E������������ԭ�Ӱ뾶��С��Ԫ�ء���ش�
��1��D��Ԫ�����ڱ��е�λ���� ��
��2��C2B�ĵ���ʽ�� ��AB2�Ľṹʽ�� ��
��3��B��C��E�����Ӱ뾶�ɴ�С��˳��Ϊ ���û�ѧʽ�ش���ͬ����A��D��EԪ������������Ӧˮ�����������ǿ����Ϊ ��
��4��B����̬�⻯����H2S��ȷе�ߵ��� ���û�ѧʽ�ش𣩣�ԭ���� ��
��5��ˮ���̺������꣬����ʹ��ߺ�����Ⱦɫ��ʹˮ������ζ��EB2����������ȥˮ�г����Mn2+�����ɺ�ɫ����MnO2��������13.50gEB2ʱ����ת����1mol���ӣ���Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������״���������г���84����Һ������������Ч�ɷ�ΪNaClO��Һ������Ҫ�ǻ��ڴ����ᣨHClO���������ԡ������ڵ�±��Ԫ���������������й㷺Ӧ�ã��ش��������⣺
��1����̬��ԭ�ӵĺ���۵����Ų�ʽΪ__________��HClO����������ԭ�ӵ��ӻ��������Ϊ__________��
��2������ũҩ��ԭ��PSCl3�У�P��S��Cl�ĵ縺���ɴ�С��˳��Ϊ_________��
��3������Cl���ڵ�Ԫ��S��F���仯����SF6���㷺������ѹ�����豸�ľ�Ե���ʡ�SF6��һ�ֹ��ۻ������ͨ��������Born��Haberѭ��������������ͼ��a��������ؼ��ܣ���S��F���ļ���Ϊ__________��
��������γɵ���״������ṹ��ͼ��C�����仯ѧʽΪ__________��
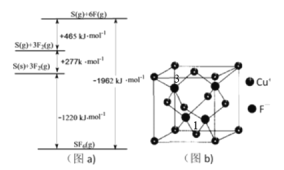
��4��CuCl���۵�Ϊ426�棬�ۻ�ʱ���������磻CuF���۵�Ϊ908�档
��CuF���۵��CuCl�ĸߣ�ԭ����_________��
�ڹ�ҵ�Ͻ�CuCl����KCN��Һ�����Ƴɶ�ͭҺ����ͭҺ������ﻯѧʽΪ__________��д��һ�������廥Ϊ�ȵ�����������ӵĵ���ʽ__________��
��CuF������ͼ��b���������߳�Ϊa nm����Cu����F������ľ���Ϊ________����Mg��mol��1��ʾCuF��Ħ��������NA��ʾ�����ӵ�������ֵ����CuF������ܶ�Ϊ______g��cm��3��
���Ծ�������Ϊ��λ���Ƚ���������ϵ���Ա�ʾ�����и�ԭ�ӵ�λ�ã�����ԭ�ӷ������꣬����ͼ��b��������1������Ϊ��![]() ��
��![]() ��0����������3������Ϊ__________��
��0����������3������Ϊ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com