
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。

(1)A中发生反应的化学方程式:_______________________________ ,B的作用:________________________;
(2)M处发生的反应的化学方程式为:______________________________________
(3)该实验过程中催化剂______________ (填“参加”或“不参加”)了化学反应
(4)乙醇氧化产物是_____________,乙醇可以和酸性高锰酸钾溶液反应被直接氧化成为______________________。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有____。要除去该物质,可现在混合液中加入_____(填写字母)。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
【答案】 2H2O2 ![]() 2H2O+O2↑ 干燥氧气 2CH3CH2OH+O2
2H2O+O2↑ 干燥氧气 2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O 参加 乙醛 乙酸 CH3COOH C
2CH3CHO+2H2O 参加 乙醛 乙酸 CH3COOH C
【解析】(1)A中是过氧化氢在二氧化锰催化作用下生成水和氧气;(2)M处是乙醇的催化氧化反应生成乙醛;(3)催化剂参加了化学反应;(4)乙醇被氧氧气化为乙醛,乙醇可以和酸性高锰酸钾溶液反应被直接氧化成为乙酸;(5)能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应。
乙醇催化氧化实验:A中是过氧化氢在二氧化锰催化作用下生成水和氧气,B是吸收氧气中的水蒸气,C是加热乙醇得到乙醇蒸气进入M,M处发生的反应是乙醇的催化氧化反应生成乙醛,F为乙醛和过量的乙醇的溶液。
(1)A中是过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为2H2O2 ![]() 2H2O+O2↑;B是吸收氧气中的水蒸气;(2)M处发生的反应是乙醇的催化氧化反应生成乙醛,反应的化学方程式为:2CH3CH2OH+O2
2H2O+O2↑;B是吸收氧气中的水蒸气;(2)M处发生的反应是乙醇的催化氧化反应生成乙醛,反应的化学方程式为:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;(3)在反应前后,实际上铜参加反应,只是在初始反应中作反应物,在最终反应中作生成物,该实验过程中催化剂参加了化学反应;(4)乙醇被氧化为乙醛,氧化产物为乙醛;乙醇可以和酸性高锰酸钾溶液反应被直接氧化成为乙酸;(5)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有CH3COOH,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,答案选C。
2CH3CHO+2H2O;(3)在反应前后,实际上铜参加反应,只是在初始反应中作反应物,在最终反应中作生成物,该实验过程中催化剂参加了化学反应;(4)乙醇被氧化为乙醛,氧化产物为乙醛;乙醇可以和酸性高锰酸钾溶液反应被直接氧化成为乙酸;(5)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有CH3COOH,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,答案选C。


科目:高中化学 来源: 题型:
【题目】(1)工业上用钛矿石(主要成分为FeTiO3,主要含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:

其中,步骤II发生的主要反应为:2H2SO4+ FeTiO3=TiOSO4+FeSO4+2H2O
①步骤I发生反应的离了方程式是:_____________、___________。为提高钛矿石的碱浸出速率,步骤I可采取的办法除提高碱的浓度外,还可以采取的办法有_________________、__________________________(写出两种方法)。
②步骤II中加入Fe的目的是___________________;分离出FeSO4晶体的操作是___________。
③步骤III形成的TiO2·nH2O 为胶体,其反应的化学方程式为____________________。
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是____________,可能生成的气体是__________________。
方法二: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g)![]() TiCl4(g)+O2(g) △H=+ 151kJ/mol
TiCl4(g)+O2(g) △H=+ 151kJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
实际生产中,需在反应①过程中加入碳,可以顺利制得TiCl4。碳的作用除燃烧放热外,还具有的作用是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_____________________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________________________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1)A的名称是_________;C的官能团的名称是_________。
(2)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_________ .
(3)E分子中含有两个酯基,且为顺式结构,E的结构简式为_________ .
(4)反应①的化学方程式为_________ 。
(5)试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6)已知:  。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成
。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成![]() 。将以下合成路线补充完整:_________________
。将以下合成路线补充完整:_________________

(7)已知氨基(-NH2)与羟基类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
试回答下列问题:
(1)大小烧杯间填满碎纸条的作用是;
(2)大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”、“偏小”或“无影响”),结合日常生活的实际该实验在进行效果更好;
(3)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”、“不相等”),简述理由:;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL 0.5mo1L﹣1NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,A(g)+3B(g) ![]() 2C(g)达平衡的标志是( )
2C(g)达平衡的标志是( )
A.单位时间内减少xmolA,同时减少3xmolB
B.反应不再进行
C.当n(A):n(B):n(C)=1:3:2时
D.混合体系的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的氮肥,合成原理为:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
(1)写出平衡常数K的表达式 , 如果降低温度,该反应K值E,化学反应速率 , N2的转化率(填“增大”、“减小”或“不变”).
(2)在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题: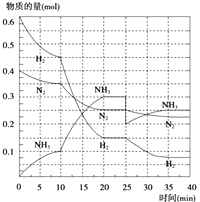
①10min内以NH3表示的平均反应速率: .
②在10~20min内:NH3浓度变化的原因可能是
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
③第1次平衡的时间为: , 第2次平衡的时间为: , 第1次平衡:平衡常数K1= (带数据的表达式),第2次平衡时NH3的体积分数;
④在反应进行至25min时,曲线发生变化的原因: ,
达第二次平衡时,新平衡的平衡常数K2K1 , (填“大于”、“小于”或“等于”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com