
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
试回答下列问题:
(1)大小烧杯间填满碎纸条的作用是;
(2)大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”、“偏小”或“无影响”),结合日常生活的实际该实验在进行效果更好;
(3)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”、“不相等”),简述理由:;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL 0.5mo1L﹣1NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”或“无影响”)
【答案】
(1)减少实验过程中的热量损失
(2)偏小,保温杯
(3)不相等,反应放出的热量和所用酸以及碱的量的多少有关
(4)偏小,无影响
【解析】解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
所以答案是:减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;在日常生活实际该实验在保温杯中效果更好;
所以答案是:偏小;保温杯;
(3)反应放出的热量和所用酸以及碱的量的多少有关,用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
所以答案是:不相等;反应放出的热量和所用酸以及碱的量的多少有关;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,中和热的数值会偏小;
中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用5mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值无影响;
所以答案是:偏小;无影响.


科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是______。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为石蜡油分解的实验装置。在试管①中加入石蜡油和氧化铝;试管②放在冷水中;试管③中加入酸性高锰酸钾溶液;试管④中加入溴水。分析实验完成下列各题:

分析实验回答下列问题:
(1)试管①中加入氧化铝的作用是____________________________________________。
(2)试管②内看到的实验现象是______________________________________________。
(3)试管③中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(4)试管④中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(5)通过本实验说明______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。

(1)A中发生反应的化学方程式:_______________________________ ,B的作用:________________________;
(2)M处发生的反应的化学方程式为:______________________________________
(3)该实验过程中催化剂______________ (填“参加”或“不参加”)了化学反应
(4)乙醇氧化产物是_____________,乙醇可以和酸性高锰酸钾溶液反应被直接氧化成为______________________。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有____。要除去该物质,可现在混合液中加入_____(填写字母)。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )

A. ①②③ B. ②③④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B2C,在反应过程中C的物质的量分数随温度变化如图所示: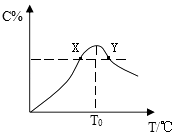
(1)T0对应的反应速率v(正)v(逆)(用“=”、“>”或“<”表示,下同);
(2)此反应的正反应为热;(填“放”或“吸”)
(3)X、Y两点A物质正反应速率的大小关系是YX;
(4)温度T<T0时,C%逐渐增大的原因是:;
(5)若Y点的C的物质的量分数为25%,则参加反应的A物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A. C生成的速率是A反应速率的2倍
B. A、B、C的浓度不再变化
C. 单位时间内生成nmol A,同时生成3nmol B
D. A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: 下列说法不正确的是
下列说法不正确的是
A. 该原子的质量数为34 B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A。合成线路如下:
}及阻燃剂四溴双酚A。合成线路如下:

已知:① X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]()
②
③![]()
(1)X的分子式为_______________;B的名称是_________________。
(2)B→C还需要的反应试剂及条件是_______________。C→D的反应类型是________。
(3)写出X→Y的化学方程式:_________________________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗_____molNaOH。
(5)符合以下条件的D的同分异构体有_______种(不考虑空间异构)。
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为: ![]() ,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,,写出合成该涂料的反应流程图:______________________________________________。
,,写出合成该涂料的反应流程图:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com