
一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是
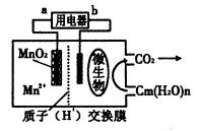
A.电池工作时,电子由a流向b
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H+ +2e— ===Mn2+ +2 H2O
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2014-2015学年四川省高三下学期3月月考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸性高锰酸钾溶液与草酸溶液的反应速率是先慢后快再变慢
B.碳酸钠是发酵粉的主要成分,而碳酸氢钠是治疗胃穿孔的一种药剂
C.一般用稀的(NH4)2SO4溶液分离提纯鸡蛋清溶液
D.工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:实验题
(10分)下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。

试回答:
(1)A中发生的化学反应方程式为 。
(2)C、D、G中各装的药品:C__________;D__________;G__________。
(3)E中的现象为 ;反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,(SO42—)=0.8 mol·L-1,则c(K+)为
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:填空题
(14分)目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大。

I.铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。铅蓄电池充放电的总反应方程式为:
PbO2+Pb+2H2SO4  2PbSO4+2H2O,
2PbSO4+2H2O,
请根据上述情况判断:
(1)电池的负极材料是 。
(2)充电时,铅蓄电池阳极的电极反应式为 。
Ⅱ.铅蓄电池使用量的急速增加引起铅污染日益严重,工业上从废铅蓄电池的铅膏回收铅的一种工艺流程如下:

请回答下列问题:
(3)为提高步骤①的化学反应速率,你认为可采取的措施是 (写一条即可)。
(4)写出步骤①中PbSO4转化为PbCO3反应的平衡常数表达式:K = 。
(5)步骤①中发生氧化还原反应的化学方程式为 。
(6)步骤③从母液可获得的副产品为 (写化学式)。
(7)已知:PbCO3在一定条件下可制得PbO,PbO通过进一步反应可制得Pb,写出一个由PbO生成Pb的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:
2KClO3+H2C2O4+H2SO4  2ClO2↑+K2SO4+2CO2↑+2H2O
2ClO2↑+K2SO4+2CO2↑+2H2O
据此,下列说法不正确的是
A.KClO3发生还原反应
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.每1 mol ClO2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:计算题
(6分)将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。

(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:选择题
下列有关实验操作不能达到相应目的的是
|
|
|
|
A.干燥Cl2 | B.分离汽油与食盐溶液 | C.实验室制取少量蒸馏水 | D.比较Na2CO3与NaHCO3的稳定性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:实验题
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。

(1)该组同学为了制取Cl2,SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。在此实验中,发生装置B应选择三种装置中的___________(选填序号),F的作用是_____________。
(2)D装置中主要反应的离子方程式为__________________________。
(3)为检验通入D装置中的Cl2是否过量,该组同学取适量D溶液滴加至盛有少量紫色石蕊的试管中,若出现___________现象,则Cl2过量,此时E中发生的离子反应方程式为______________________,若D中出现__________________实验现象,则氯气不过量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com