
(6分)将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。

(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
(6分)(1)3.9g;(2)2.4g;(3)4mol/L 。
【解析】
试题分析:(1)把一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,发生反应:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,,然后向该溶液中加入NaOH溶液,首先发生反应:HCl+NaOH=NaCl+H2O,然后发生反应:MgCl2+ 2NaOH=Mg(OH)2↓+ 2NaCl; AlCl3+ 3NaOH=Al(OH)3↓+ 3NaCl;由于Al(OH)3是两性氢氧化物,可以与强碱发生反应,所以当NaOH过量时,会发生反应:Al(OH)3+ NaOH=NaAlO2+2H2O,而Mg(OH)2不能与过量的强碱反应,所以根据图像可知:沉淀最大值时是Al(OH)3和Mg(OH)2的混合物,质量为9.7g,当沉淀不再减少时的质量为Mg(OH)2的质量,二者的质量差为Al(OH)3的质量,所以m[Al(OH)3]=9.7g-5.8g=3.9g;(2)根据Mg元素守恒可得n(Mg)=n[Mg(OH)2]= 5.8g÷58 g/mol=0.1mol,则m(Mg)=nM=0.1mol×24g/mol=2.4g;当沉淀达到最大值时,溶液中的溶质是NaCl,则n(HCl)=n(NaOH)= 5 mol/L×0.08L=0.4mol,所以c(HCl)= n(HCl) ÷V=0.4mol÷0.1L=4mol/L。
考点:考查根据化学反应方程式的计算的知识。
考点分析: 考点1:镁铝及其化合物 试题属性

科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:选择题
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是

A.X的化学式为C10H10O6
B.X在一定条件下能与FeCl3溶液发生显色反应
C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
D.X在一定条件下能发生消去反应和酯化反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是
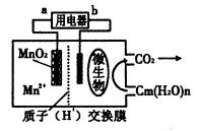
A.电池工作时,电子由a流向b
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H+ +2e— ===Mn2+ +2 H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
下列化学反应对应的离子方程式书写正确的是
A.醋酸溶液与Mg(OH) 2反应:Mg(OH) 2 +2H+ ===Mg2+ +2H2O
B.碳酸钠溶液呈碱性:CO32— +2H2O  H2CO3 +2OH—
H2CO3 +2OH—
C.NH4HC03溶液与过量NaOH溶液反应:NH4+ +OH— ===NH3·H2O
D.用惰性电极电解饱和食盐溶液:2Cl—+2H2O  2OH— +Cl2↑+H2↑
2OH— +Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:填空题
(6分)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:选择题
某溶液中含有大量的下列离子:X离子、NH4+、Cl-和Al3+,经测定X离子、NH4+、Cl-和Al3+的物质的量浓度之比为2∶1∶5∶2,则X离子可能是
A.OH- B.Na+ C.NO3- D.Ag+
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高二上学期学期期末化学试卷(解析版) 题型:填空题
(6分)某温度下,将4.0 mol的HI气体充入1 L已经抽空的固定容积的密闭容器中,发生如下反应:2HI(g) H2(g)+I2(g) ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
H2(g)+I2(g) ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s n /mol | 0 | 40 | 80 | 120 |
n(HI) | 4.0 | 2.8 | b | c |
n(H2) | 0 | a | 1.0 | 1.0 |
(1)a = ,c = ;
(2)计算在该温度时此反应的平衡常数K = ;
(3)保持温度不变,120 s时再通入2.0 mol的H2。当再次达到平衡时,HI的平衡转化率是多少?(本小题要有适当的解题过程)
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
海带中含碘元素,有人设计如下步骤来提取碘:
①通适量Cl2;②将海带烧成灰,向灰中加水搅拌;③加CCl4振荡;④过滤;⑤用分液漏斗分液。正确的步骤顺序是
A.①③⑤②④ B.②④③①⑤ C.②④①③⑤ D.③①②⑤④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com