
(10分)下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。

试回答:
(1)A中发生的化学反应方程式为 。
(2)C、D、G中各装的药品:C__________;D__________;G__________。
(3)E中的现象为 ;反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因 。
1)MnO2+4HCl(浓)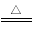 MnCl2+Cl2↑+2H2O (2)饱和NaCl溶液;浓H2SO4 ;NaOH溶液
MnCl2+Cl2↑+2H2O (2)饱和NaCl溶液;浓H2SO4 ;NaOH溶液
(3)剧烈反应,产生棕黑色(棕褐色)的烟,放出大量热;2 Fe +3Cl2  2FeCl3
2FeCl3
(4)Cl2+2 OH-=Cl-+ ClO- + H2O (2分) (5)Cl2+SO 2+2H2O=H2SO4+ 2HCl (2分) 其余各1分
【解析】
试题分析:(1)A装置用来制备氯气,发生反应的化学反应方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)由于生成的氯气中含有水蒸气和挥发出来的氯化氢,因此再与铁反应之前需要除去,所以先用饱和食盐水除去水蒸气,再用浓硫酸干燥氯气。又因为氯气属于大气污染物,需要尾气处理,一般用氢氧化钠溶液吸收多余的氯气,则C、D、G中各装的药品分别是饱和NaCl溶液;浓H2SO4 ;NaOH溶液。
(3)在加热的条件下氯气与铁反应生成氯化铁,所以E中的现象为剧烈反应,产生棕黑色(棕褐色)的烟,放出大量热,反应方程式为2 Fe +3Cl2  2FeCl3。
2FeCl3。
(4)氯气与氢氧化钠溶液反应的离子方程式为Cl2+2 OH-=Cl-+ ClO- + H2O。
(5)氯气具有强氧化性,SO2具有还原性,二者在溶液中发生氧化还原反应生成盐酸和硫酸,从而降低甚至完全失去漂白性。
考点:考查氯气制备及性质实验方案设计与探究
考点分析: 考点1:物质的制备 考点2:卤素 试题属性

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年广东省中山市高三下学期第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2 +2H2O+4e-=4OH—
D.工业上电解饱和食盐水的阴极反应:2Cl一 一2e一=C12↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:选择题
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是

A.X的化学式为C10H10O6
B.X在一定条件下能与FeCl3溶液发生显色反应
C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
D.X在一定条件下能发生消去反应和酯化反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省七市教科研协作体高三3月联考化学试卷(解析版) 题型:填空题
【化学-选修2 化学与技术】
下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题:

(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为_______________。
3CO2+4Al,则阳极的电极反应式为_______________。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________。(热回收效率= 回收能量/生产耗能 x100%)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为
A.0.05 mol B.1 mol C.1.05 mol D.0.13 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是
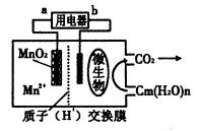
A.电池工作时,电子由a流向b
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H+ +2e— ===Mn2+ +2 H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高二上学期学期期末化学试卷(解析版) 题型:填空题
(6分)某温度下,将4.0 mol的HI气体充入1 L已经抽空的固定容积的密闭容器中,发生如下反应:2HI(g)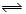 H2(g)+I2(g) ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
H2(g)+I2(g) ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s n /mol | 0 | 40 | 80 | 120 |
n(HI) | 4.0 | 2.8 | b | c |
n(H2) | 0 | a | 1.0 | 1.0 |
(1)a = ,c = ;
(2)计算在该温度时此反应的平衡常数K = ;
(3)保持温度不变,120 s时再通入2.0 mol的H2。当再次达到平衡时,HI的平衡转化率是多少?(本小题要有适当的解题过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com