
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在3种离子
B.Cl-一定存在,且c(Cl)≥0.4mol/L
C.SO42-、NH4+、一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
【答案】B
【解析】
加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,物质的量为0.02mol;红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,物质的量为![]() ;Fe3+与CO32-不能共存,则一定没有CO32-;4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,则溶液中含有SO42-,物质的量为
;Fe3+与CO32-不能共存,则一定没有CO32-;4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,则溶液中含有SO42-,物质的量为![]() ;
;
A. 由上述分析可知,一定含SO42-、NH4+、Fe3+,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,据电荷守恒,知溶液中必然大量存在另一种阴离子Cl-,故A错误;
B. 由电荷守恒可知,Cl-一定存在,且c(Cl-)≥0.4mol/L,故B正确;
C. 由上述分析可知,SO42-、NH4+、Fe3+、Cl-一定存在,故C错误;
D. 综上所述,原溶液中一定含Fe3+、NH4+、SO42-和Cl-,可能含Al3+、K+,一定不含CO32-,故D错误;
故选B。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法正确的是
A.0.1molKHSO4晶体中含有H+数为0.1NA
B.标准状况下,5.6LSO3分子中含有的电子总数为10NA
C.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为3NA
D.33.6gFe与足量的水蒸气加热充分反应,转移电子数为1.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2晶体的部分结构如图所示,关于该晶体下列说法错误的是( )

A.Si原子杂化类型为sp3
B.Si、O的原子个数比为1:4
C.Si原子数目与Si—O键数目比为1:4
D.SiO2晶体中最小环为12元环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
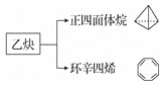
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图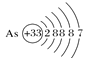 B.BF4—的结构式
B.BF4—的结构式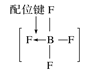
C.HF分子间的氢键 D.丙氨酸的手性异构
D.丙氨酸的手性异构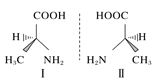
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)![]() 分子的晶体中,在晶胞的顶点和面心均含有一个
分子的晶体中,在晶胞的顶点和面心均含有一个![]() 分子,则一个
分子,则一个![]() 晶胞的质量为_______。
晶胞的质量为_______。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是_____(填字母)。
a.晶体的熔点:干冰>冰
b.晶体中的空间利用率:干冰>冰
c.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是______(填字母)。
a.金刚石中碳原子的杂化类型为![]() 杂化,石墨中碳原子的杂化类型为
杂化,石墨中碳原子的杂化类型为![]() 杂化
杂化
b.晶体中共价键的键长:金刚石中![]() <石墨中
<石墨中![]()
C.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
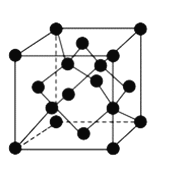
(4)金刚石晶胞结构如下图,立方![]() 结构与金刚石相似,在
结构与金刚石相似,在![]() 晶体中,
晶体中,![]() 原子周围最近的
原子周围最近的![]() 原子所构成的立体图形为_______,
原子所构成的立体图形为_______,![]() 原子与
原子与![]() 原子之间共价键与配位键的数目比为_______,一个晶胞中
原子之间共价键与配位键的数目比为_______,一个晶胞中![]() 原子数目为___________。
原子数目为___________。
(5)已知![]() 单质的晶体密度为
单质的晶体密度为![]() ,
,![]() 的相对原子质量为
的相对原子质量为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则
,则![]() 的原子半径为_________。
的原子半径为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,有科研工作者提出可用如图所示装置进行水产养殖用水的净化处理。该装置工作时,下列说法错误的是
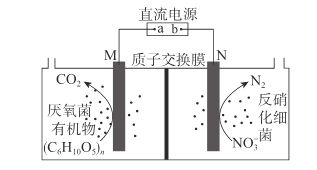
A.导线中电子由M电极流向a极
B.N极的电极反应式为2NO3-+10e-+12H+=N2↑+6H2O
C.当电路中通过24 mol电子的电量时,理论上有1 mol (C6H10O5)n参加反应
D.当生成1 mol N2时,理论上有10 mol H+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是( )
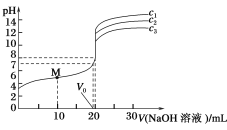
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C.恰好中和时,溶液中离子浓度的大小关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D.由pH=7的溶液计算得:Ka=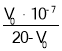 (V0是消耗的NaOH溶液的体积)
(V0是消耗的NaOH溶液的体积)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com