
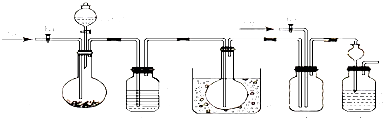


科目:高中化学 来源: 题型:
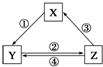 下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Na2CO3 | NaOH | NaHCO3 | ④过量Ca(OH)2溶液 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
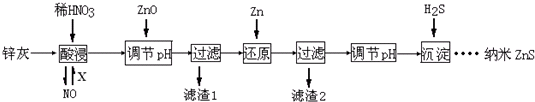
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、SO42-、Cu2+、NO3- |
| B、Ag+、Fe3+、Cl-、SO42- |
| C、H+、I-、NO3-、SiO32- |
| D、NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸存放在带橡皮塞的棕色玻璃瓶中 |
| B、汽油或煤油存放在带橡皮塞的棕色玻璃瓶中 |
| C、碳酸钠溶液存放在配有磨口塞的棕色玻璃瓶中 |
| D、氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
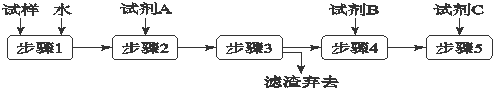
| A、步骤3的操作名称是过滤 |
| B、步骤1所需玻璃仪器是烧杯和玻璃棒 |
| C、试剂A是BaCl2溶液 |
| D、加入试剂A 的目的是除去CO32-并避免对Cl-或OH-的检验的干扰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com