
| V |
| Vm |
| m |
| ρ |
| n |
| V |
| 溶质质量 |
| 溶液质量 |
| 150L |
| 22.4L/mol |
| 150 |
| 22.4 |
| 150 |
| 22.4 |
| 150 |
| 22.4 |
1000g+
| ||
| 1100g/L |
| ||||
|
| ||
1000g+
|


科目:高中化学 来源: 题型:
| A、电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 |
| B、能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 |
| C、能层序数越大,s原子轨道的半径越大 |
| D、在同一能级上运动的电子,其运动状态肯定不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烧杯产生的氢气比乙烧杯少 |
| B、乙烧杯中的酸一定过量 |
| C、两烧杯中参加反应的锌等量 |
| D、反应开始时乙烧杯中产生氢气的速率比甲烧杯快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加适量的CH3COONa晶体,两溶液的氢离子浓度都减小 |
| B、使温度升高20℃,两溶液的氢离子浓度都不变 |
| C、与等浓度的NaOH溶液反应,消耗NaOH溶液的体积一样多 |
| D、加足量的Zn充分反应后,两溶液中产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
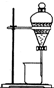 某同学为了验证海带中含有碘元素并提取碘单质,拟进行如下实验,请回答相关问题.
某同学为了验证海带中含有碘元素并提取碘单质,拟进行如下实验,请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④⑤ |
| C、②③⑤ | D、①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com