
| 1000ρω |
| M |
| n |
| V |
| 1000×1.84g/L×98% |
| 98g/mol |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.012 kg碳 |
| B、含有6.02×1023个粒子的物质 |
| C、含有阿伏加德罗常数个粒子的物质 |
| D、含有与6.02×1023个碳原子等质量的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 120℃ | 300℃ | 480℃ | |
| 化学式 | KxFey(C2O4)Z | KxFeyO(C2O4)Z-1 | KxFeyO2(C2O4)Z-2 |
| 质量 | 4.370g | 3.650g | 2.930g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、剩余固体是铁、铜混合物 |
| B、原固体混合物中铜的质量是9.6g |
| C、反应后溶液中n(Fe3+)=0.10mol |
| D、反应后溶液中n(Fe2+)+n(Cu2+)=0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②④ | C、①③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
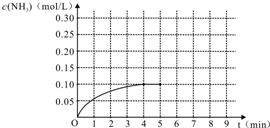 在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度随时间的变化情况如图:
在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度随时间的变化情况如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com