
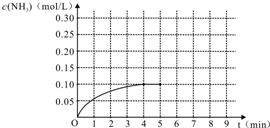
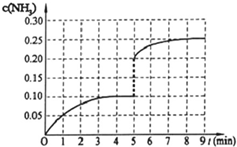
 在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度随时间的变化情况如图:
在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度随时间的变化情况如图:| △c |
| △t |
| 0.1mol/L |
| 4min |
 ,
, .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④⑤ |
| C、②③⑤ | D、①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:
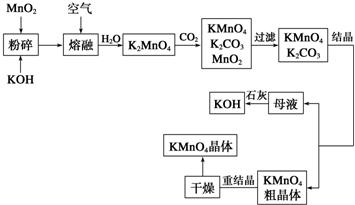
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 小苏打可用于治疗胃溃疡 | NaHCO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | Al(OH)3胶体有吸附性 | 明矾可用作净水剂 | Ⅰ对,Ⅱ对,有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com