
| A、提高水温 |
| B、除去水中的游离氯 |
| C、用紫外线杀菌 |
| D、增加水中的含氧量 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
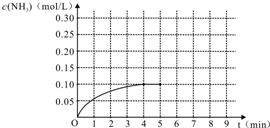 在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度随时间的变化情况如图:
在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度随时间的变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A、电源B极是正极 |
| B、(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
| C、欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 |
| D、装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B、反应Hg(1)+H2SO4(aq)=HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 |
| C、将纯水加热至较高温度,K变大、pH变小、呈酸性 |
| D、锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、②③ | C、①③ | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com