
【题目】短周期主族元素X、Y、Z、W的原子序数依次增加。A、B、C、D均是由这些元素组成的二元化合物,甲是Y的固体单质,常温下0.05mol/L乙溶液的pH为1。A是无色气体,是主要的大气污染物之一,上述物质的转化关系如图所示。下列说法错误的是( )
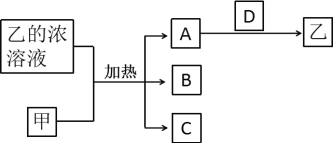
A.原子半径:X<Z<W
B.D中存在极性键和非极性键
C.最高价含氧酸的酸性:W>Y
D.化合物YZW中键角为120°
【答案】D
【解析】
已知0.05mol/L乙溶液的pH为1,c(H+)=0.1mol/L,说明乙是一种二元强酸,故乙是H2SO4,甲是碳,A是二氧化硫、B、C是二氧化碳和水中的一种,D是过氧化氢。X是氢元素,Y是碳元素,Z是氧元素,W是硫元素。
A. X为H元素,Z为O元素,W为S元素,同周期,从左到右,元素的原子半径依次减小,同主族,从上到下,元素的原子半径依次增大,所以原子半径:S>O>H,A正确;
B. D是过氧化氢,氢氧之间属于极性键,氧氧之间属于非极性键,B正确;
C. W为S元素,Y为C元素,非金属性:S>C,则酸性:H2SO4>H2CO3,硫酸是强酸,碳酸是弱酸,C正确;
D. Y为C元素,Z为O元素,W为S元素,其形成的化合物为:COS,COS的分子结构与二氧化碳相似,立体结构为直线形,键角为180°,D错误;故答案为:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(10分)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为____________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下二者完全反应,只得到CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4g,碱石灰增重4.4g,剩余气体在标准状况下的体积为2.24L,回答下列问题:
(1)写出有机化合物A的分子式___(要求写出推理过程)。
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是( )
A. 生成的乙酸乙酯中含有18OB. 生成的水分子中含有18O
C. 可能生成44 g乙酸乙酯D. 不可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应进行方向的判断,以下说法错误的是( )
A.高锰酸钾加热分解是一个熵增的过程
B.△H<0的化学反应均是自发反应,△S<0的化学反应均不能自发进行
C.能自发进行的化学反应不一定是△H<0、△S>0
D.反应2Al2O3(s)+3C(s)=2Al(s)+3CO2(g)在常温下不能自发进行,说明该反应△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗常数,下列说法正确的是
代表阿伏加德罗常数,下列说法正确的是 ![]()
![]()
A.![]() 中,生成
中,生成![]() 标准状况
标准状况![]() 转移电子数为
转移电子数为![]()
B.56gFe与一定量的稀硝酸反应,转移电子数可能为![]()
C.足量的![]() 与一定量的浓盐酸反应得到
与一定量的浓盐酸反应得到![]() ,若向反应后的溶液中加入足量的
,若向反应后的溶液中加入足量的![]() ,则生成AgCl的物质的量为2mol
,则生成AgCl的物质的量为2mol
D.标准状况下,![]() 和
和![]() 混合后,原子总数小于
混合后,原子总数小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸奶中含有乳酸,乳酸在常温常压下是一种黏度很大的液体。取9.0g乳酸与足量的Na反应,在标准状况下收集到2.24L气体;另取9.0g乳酸与足量的NaHCO3溶液反应,生成的CO2气体在标准状况下的体积为2.24L。已知乳酸分子中含有一个甲基,请回答:
(1)乳酸的相对分子质量为___________________。
(2)乳酸与NaHCO3溶液反应的化学方程式为___________________。
(3)在浓硫酸存在下,两分子乳酸相互反应生成环状酯类化合物,则环状酯的结构简式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(![]() )、c(H+)均减小
)、c(H+)均减小
B.常温下,c(![]() )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3)
D.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a∶b=2∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
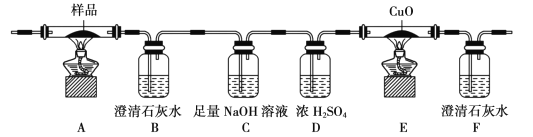
【题目】草酸及其盐是重要的化工原料,其中最常用的是三草酸合铁酸钾和草酸钴,已知草酸钴不溶于水,三草酸合铁酸钾晶体(![]() )易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。
)易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。
(l)草酸钴晶体(![]() )在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(
)在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(![]() )样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
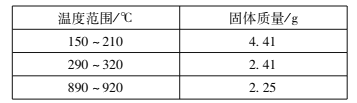
实验过程中观察到只有B中澄清石灰水明显变浑浊,E中始终没有红色固体生成。根据实验结果,290 - 320℃过程中发生反应的化学方程式是____;设置D的作用是____。
(2)用以上装置加热三草酸合铁酸钾晶体可发生分解反应。
①检查装置气密性后,先通一段时间的N2,其目的是 ___;结束实验时,先熄灭酒精灯再通入N2至常温。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则分解得到的气体产物是____。
②C的作用是是____。
(3)三草酸合铁酸钾的一种制备流程如下:
![]()
回答下列问题:
①流程“I”硫酸必须过量的原因是 ____
②流程中“Ⅲ”需控制溶液温度不高于40℃,理由是____;得到溶液后,加入乙醇,然后进行过滤。加入乙醇的理由是____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com