
【题目】下列说法中,正确的是( )
A.石油裂化的目的是获得更多的乙烯,丙烯等原料
B.石油分馏,煤的干馏发生的都是物理变化
C.油脂的皂化发生的是化学变化
D.向蛋白质溶液中分别加入硫酸铜,硫酸铵的浓溶液都可以发生盐析
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:
【题目】氢在生活、生产、科研中发挥着重要的作用。
Ⅰ.工业上利用吸热反应C(s) +2H2O(g)![]() CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
容器 | 容积/L | 温度/L | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
(l)T1_______T2 (填“>”、“ =”或“<”)。
(2)T1时达到平衡后再加入lmolH2O(g),达到新平衡后H2(g)的物质的量分数__________(填“增大”、“ 不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v(正)________v(逆)(填“大 于”、“ 等 于” 或“小于”)。
Ⅱ.CO(g)和H2(g)在一定条件下可合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(3)该反应能量变化曲线如图所示,下列叙述正确的是___________。

A.该反应的△H>0
B.该反应的活化能为419kJ
C.使用催化剂后反应速率加快,△H 不变
D.若改变条件使平衡向正反应方向移动,则CO 的转化率可能增大,可能不变,也可能减小
(4)反应分別在230℃、250℃、270℃进行时,CO的平衡转化率与![]() 的关系如图所示。
的关系如图所示。
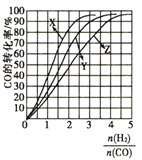
①230℃对应的曲线是_________________,依据是________________。
②向容积为1L的密闭容器中投入1nolCO、3molH2,在上述某温度下进行反应,平衡后测得![]() =
=![]() ,则反应温度为_____________,平衡常数K=_________________。
,则反应温度为_____________,平衡常数K=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明溴乙烷中溴元素的存在,现有以下操作:①加入硝酸银溶液②加入氢氧化钠溶液③加热④加入蒸馏水⑤加入稀硝酸至溶液呈酸性⑥加入氢氧化钠的醇溶液,下列是按一定顺序进行的操作步骤,其中正确的是( )
A. ④③①⑤ B. ④③⑤① C. ④⑥③① D. ②③⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是( )
A. 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液
B. 乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液
C. 乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液
D. 苯中含苯酚杂质:加入溴水,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、C、d.e、f是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 简单气态氢化物的热稳定性:X>Y
C. 图中物质的转化过程均为氧化还原反应
D. a一定由W、X两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是短周期主族元素。已知Z是地壳中含量第二位的元素,W在短周期主族元素中原子半径最大,Z、X、Y在元素周期表中的相对位置如图所示。下列说法正确的是

A. Z的氧化物属于酸性氧化物,能与水反应生成相应的酸
B. W2Y和W2Y2中阴、阳离子的个数比相同,化学键类型不完全相同
C. X、Y与氢三种元素形成的物质中一定不含离子键
D. X和Y只能形成一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。
Ⅰ.实验步骤
(1)配制100ml待测白醋溶液:用(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴作指示剂。![]()
(3)读取盛装0.1000 mol·L-1 NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为mL。
(4)滴定。当时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
(5)Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00[ | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
①按实验所得数据,可得c(市售白醋)=mol·L-1;
市售白醋总酸量=g·100 mL-1。
②在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol·L-1的三种碱溶液。滴定曲线如图所示,下列判断正确的是
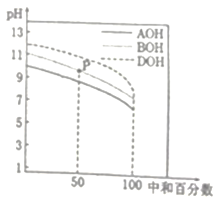
A. 滴定前,三种碱液中水电离的c(H+)大小关系:DOH>BOH>AOH
B. 满定至P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,c(A+)=c(B+)=c(D+)
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH) =c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质混合后,有白色沉淀生成的是( )
A.AlCl3溶液中逐滴滴入过量氨水B.CuCl2溶液滴加NaOH溶液
C.NaHCO3溶液中滴加NaOH溶液D.CO2通入NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com