
【题目】氢在生活、生产、科研中发挥着重要的作用。
Ⅰ.工业上利用吸热反应C(s) +2H2O(g)![]() CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
容器 | 容积/L | 温度/L | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
(l)T1_______T2 (填“>”、“ =”或“<”)。
(2)T1时达到平衡后再加入lmolH2O(g),达到新平衡后H2(g)的物质的量分数__________(填“增大”、“ 不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v(正)________v(逆)(填“大 于”、“ 等 于” 或“小于”)。
Ⅱ.CO(g)和H2(g)在一定条件下可合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(3)该反应能量变化曲线如图所示,下列叙述正确的是___________。

A.该反应的△H>0
B.该反应的活化能为419kJ
C.使用催化剂后反应速率加快,△H 不变
D.若改变条件使平衡向正反应方向移动,则CO 的转化率可能增大,可能不变,也可能减小
(4)反应分別在230℃、250℃、270℃进行时,CO的平衡转化率与![]() 的关系如图所示。
的关系如图所示。
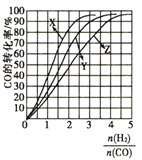
①230℃对应的曲线是_________________,依据是________________。
②向容积为1L的密闭容器中投入1nolCO、3molH2,在上述某温度下进行反应,平衡后测得![]() =
=![]() ,则反应温度为_____________,平衡常数K=_________________。
,则反应温度为_____________,平衡常数K=_________________。
【答案】 > 减小 小于 CD X 对于放热反应,其它条件不变时,温度越低反应物的转化率越高 250℃ 5.625
【解析】(l)根据表中数据甲的体积和起始投料均为乙的二倍,若温度相同则为等效平衡,平衡时氢气的量也应为乙的二倍,则乙中氢气应为1.6mol,实际只有1.2mol,反应为吸热反应,温度降低平衡逆向移动氢气的含量减小,故T1>T2;(2)T1时达到平衡后再加入lmolH2O(g),平衡转移消耗的水比加入的少得多,故达到新平衡后H2(g)的物质的量分数减小;T2时,K=![]() ,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时Q=
,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时Q=![]() ,反应逆向移动,v(正)小于v(逆);(3) A.由图中信息可知,该反应反应物的总能量大于生成物的总能量,故△H<0,选项A错误;B.该反应没有催化剂条件下正反应的的活化能为419kJ/mol,选项B错误;C.使用催化剂后反应速率加快,但催化剂只能改变反应的活化能,不能改变焓变,故△H不变,选项C正确;D.若改变条件使平衡向正反应方向移动,则CO的转化率可能增大,可能不变,也可能减小,选项D正确。答案选CD;(4)①反应CO(g)+2H2(g)
,反应逆向移动,v(正)小于v(逆);(3) A.由图中信息可知,该反应反应物的总能量大于生成物的总能量,故△H<0,选项A错误;B.该反应没有催化剂条件下正反应的的活化能为419kJ/mol,选项B错误;C.使用催化剂后反应速率加快,但催化剂只能改变反应的活化能,不能改变焓变,故△H不变,选项C正确;D.若改变条件使平衡向正反应方向移动,则CO的转化率可能增大,可能不变,也可能减小,选项D正确。答案选CD;(4)①反应CO(g)+2H2(g)![]() CH3OH(g)为放热反应,升高温度反应逆向移动,CO的转化率降低,故230℃对应的曲线是X,依据是对于放热反应,其它条件不变时,温度越低反应物的转化率越高;
CH3OH(g)为放热反应,升高温度反应逆向移动,CO的转化率降低,故230℃对应的曲线是X,依据是对于放热反应,其它条件不变时,温度越低反应物的转化率越高;
②平衡后测得![]() =
=![]() ,设
,设![]() ,
,![]() ,故
,故
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始时的浓度(mol/L) 1 3 0
改变的浓度(mol/L) 0.9 3-4x 3x
平衡时的浓度(mol/L) 0.1 4x=1.2 3x=0.9
根据反应有3-4x=2×3x,x=0.3,代入以上数据,则![]() 时,CO的转化率为
时,CO的转化率为![]() ,对应的温度应该为250℃,平衡常数K=
,对应的温度应该为250℃,平衡常数K=![]() 5.625。
5.625。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2 )是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。下列叙述不正确的是

A. 常温下,pKb2=-1gKb2 =7.15
B. 溶液中水的电离程度:a点大于b点
C. H3NCH2CH2NH2Cl2 溶液中c(H+)>c(OH-)
D. 曲线G代表pH 与![]() 的变化关系
的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+NH3(g)=GaN(s)+3HCl(g) H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g)H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) H3
由上述反应可知H3=_____________。
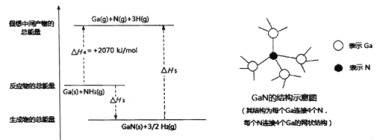
已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____molGa-N键,拆开lmolGa-N键所需能量为______kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:
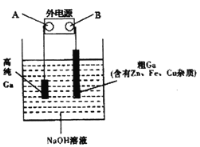
已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____极,电解精炼镓时产生阳极泥的主要成分是___________。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________。(η=生成目标产物消耗的电子数÷转移的电子总数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图象中,纵坐标为沉淀物的物质的悬,横坐标为向溶液中加入反应物的物质的量,则相应的图象序号与(1)﹣(4)对应的是 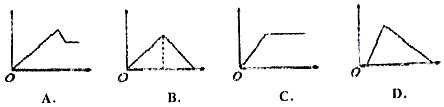
溶液 | 加入物质 | 对应的图象 |
⑴饱和石灰水 | 通过量CO2气体 | |
⑵氯化铝溶液 | 加入过量氨水 | |
⑶MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | |
⑷含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于同系物的是 ( )
A.CH2=CH2和CH2=CHCH=CH2 B.CH3CH2Cl和CH2ClCH2CH2Cl
C.C2H5OH和CH4O D.CH3COOH和C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴越小组对其组成进行探究。
已知Cu2O在酸性溶液中会发生歧化反应:Cu2O+2H+=Cu+Cu2++H2O。
方案一:
(1)学生甲取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出样品中一定含有_______,写出产生上述气体的化学方程式_____________。
(2)进一步探究样品中另一种成分。实验操作步骤为:取少量上述反应后溶液,加入______(填化学式)溶液,观察现象。
方案二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的____。
A.若固体全部溶解,说明样品一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
方案三:
学生丙利用下图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
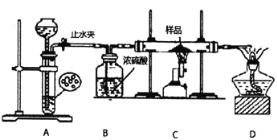
(4)装置A是氢气的发生装置,可以使用的药品是______(填选项)。
A.氢氧化钠溶液和铝片 B.稀硝酸和铁片 C.稀硫酸利锌片 D.浓硫酸和镁片
(5)下列实验步骤的先后顺序是_____(填序号)。
①打开止水夹 ②关闭止水夹 ③点燃C处的酒精喷灯
④熄灭C处的酒精喷灯 ⑤收集氢气并验纯
(6)假设样品全部参加反应生成相应金属单质,若实验前样品的质量为15.2g,实验后称得装置C中固体的质最为12.0g。则样品的组成是(若有多种成分,则须求出各成分的质量)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境已成为当前和未来的全球性的重大课题之一,下列因为人类生产对环境破坏而带来的后果是( )
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
A.①②⑤
B.①②④⑤
C.②⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.石油裂化的目的是获得更多的乙烯,丙烯等原料
B.石油分馏,煤的干馏发生的都是物理变化
C.油脂的皂化发生的是化学变化
D.向蛋白质溶液中分别加入硫酸铜,硫酸铵的浓溶液都可以发生盐析
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com