
【题目】室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol·L-1的三种碱溶液。滴定曲线如图所示,下列判断正确的是
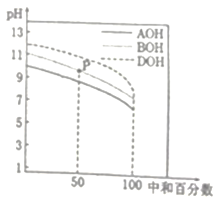
A. 滴定前,三种碱液中水电离的c(H+)大小关系:DOH>BOH>AOH
B. 满定至P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,c(A+)=c(B+)=c(D+)
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH) =c(H+)-c(OH-)
【答案】D
【解析】试题分析:三种碱的起始浓度均为0.1mol/L,由图中信息可知,起始时pH都小于13,说明三种碱均为弱碱,且碱性强弱为AOH<BOH<DOH,碱性越强,对水的电离的抑制作用越大。在相同条件下,盐水解的程度由小到大的顺序是DCl<BCl<ACl,它们水解均使溶液显酸性。A.滴定前,三种碱液中水电离的c(H+)大小关系为AOH>BOH>DOH,A不正确;B.滴定至P点时,此时中和百分数为50%,即BOH恰好有一半被中和,溶液为物质的量浓度相同的BOH和BCl混合溶液,pH>7、溶液显碱性,则BOH的电离程度大于BCl的水解程度,所以溶液中c(Cl-)<c(B+), B不正确;C.pH=7时,溶液中c(H+)=c(OH﹣),由电荷守恒可知,三种溶液中c(Cl-)均等于其c(弱碱的阳离子)。由于三种盐在相同的条件下的水解程度由小到大的顺序是DCl<BCl<ACl,且其水解均使溶液显酸性,则滴定到溶液恰好呈中性时,三种溶液中消耗HCl的体积由小到大的顺序为AOH<BOH<DOH,则三种溶液中c(Cl﹣)不相等,且c(Cl﹣)由小到大的顺序为AOH<BOH<DOH,因而c(A+)<c(B+)<c(D+),故C不正确;D.当中和百分数达100%时,三种溶液的物质的量浓度相同,混合后,根据质子守恒,c(DOH)+c(AOH)+c(BOH)+c(OH﹣)=c(H+),则c(AOH)+c(BOH)+c(DOH)=c(H+)﹣c(OH﹣),故D正确。本题选D。


科目:高中化学 来源: 题型:
【题目】保护环境已成为当前和未来的全球性的重大课题之一,下列因为人类生产对环境破坏而带来的后果是( )
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
A.①②⑤
B.①②④⑤
C.②⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.石油裂化的目的是获得更多的乙烯,丙烯等原料
B.石油分馏,煤的干馏发生的都是物理变化
C.油脂的皂化发生的是化学变化
D.向蛋白质溶液中分别加入硫酸铜,硫酸铵的浓溶液都可以发生盐析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C为同一主族,C常用于制作半导体器件和集成电路,B的简单氢化物的水溶液呈碱性,E元素的正三价离子的3d亚层为半充满,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,其在周期表中位于第4周期、第ⅣB族。
(1)A、B、C三种元素的第一电离能由小到大的顺序为______________________,电负性由小到大的顺序为____________________。
(2)B的简单氢化物易液化的原因是_______________;BH4+中B原子的杂化方式为___________,空间构型为__________________。
(3)E元素基态原子的电子排布式为____________________________________。
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于__________________晶体。
(5)D有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中D的配位数为__________________;图2为E的一种面心立方晶胞结构,若晶胞的边长为acm,NA表示阿伏加德罗常数的值,则E的密度为__________________g·cm-3(用含a和NA的代数式表示)。
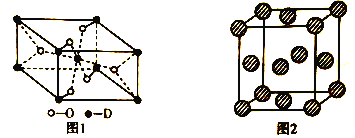
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:

(1)图示装置有两处重要组成部分未画出,它们是____________ 、_______________。
(2)烧杯间填满碎泡沫塑料的作用是 ________________。
(3)若操作时分几次注入反应液,求得的反应热数值_____(填“偏大”“偏小”或“无影响”)。
(4)做一次完整的中和热测定实验,温度计需使用__________次。
(5)量取0.5 mol/L的盐酸和0.55 mol/L的NaOH溶液各50 mL进行实验,测得盐酸和NaOH溶液起始平均温度为t1℃,混合反应后最高温度为t2℃,设溶液密度均为1 g/mL,生成溶液的比热容c= 4.18 J/(g℃)。请列式计算中和热:△H= ______________kJ/mol(不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下空白:
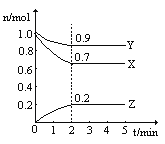
(1)该反应的化学方程式为__________;
(2)平衡时,X的转化率为_______,Y的浓度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com