
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下空白:
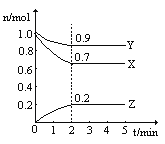
(1)该反应的化学方程式为__________;
(2)平衡时,X的转化率为_______,Y的浓度为_____________。
【答案】 3X+Y![]() 2Z 30% 0.45mol/L
2Z 30% 0.45mol/L
【解析】(1)根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写化学方程式;
(2)反应达平衡时,X的转化率为已转化的物质的量与起始物质的量的比值;根据c=![]() 计算浓度。
计算浓度。
(1)△n(X)=1.0mol-0.7mol=0.3mol;△n(Y)=1.0mol-0.9mol=0.1mol;△n(Z)=0.2mol,三者计量数之比为3:1:2,所以该反应的化学方程式为3X+Y2Z,故答案为:3X+Y2Z;
(2)X转化的物质的量为1.0mol-0.7mol=0.3mol,转化率为![]() ×100%=30%;Y的浓度c=
×100%=30%;Y的浓度c=![]() =
=![]() =0.45mol/L,故答案为:30%;0.45mol/L。
=0.45mol/L,故答案为:30%;0.45mol/L。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol·L-1的三种碱溶液。滴定曲线如图所示,下列判断正确的是
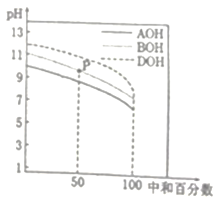
A. 滴定前,三种碱液中水电离的c(H+)大小关系:DOH>BOH>AOH
B. 满定至P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,c(A+)=c(B+)=c(D+)
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH) =c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质混合后,有白色沉淀生成的是( )
A.AlCl3溶液中逐滴滴入过量氨水B.CuCl2溶液滴加NaOH溶液
C.NaHCO3溶液中滴加NaOH溶液D.CO2通入NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q;x、y、z是由这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01mol·L-lw溶液中,![]() =1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
=1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
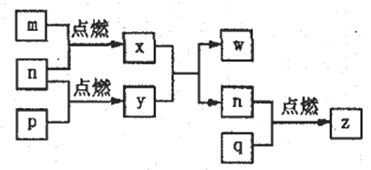
A. 原子半径的大小:a<b<c<d
B. 简单氢化物的沸点:b>d
C. y的电子式:![]()
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B和C,下列判断中正确的是
2C(g)测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B和C,下列判断中正确的是
A. 平衡不移动
B. 平衡向逆反应方向移动
C. 新平衡时各物质的浓度都比原平衡时增大
D. C的质量分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu:相对原子质量为64)。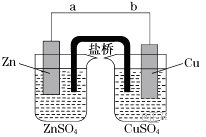
按照实验步骤依次回答下列问题:
(1)导线中电流方向为(用a、b表示)。
(2)原电池的正极为
(3)写出装置中铜电极上的电极反应式:;
(4)若装置中铜电极的质量增加32 g,则导线中转移的电子数目为;
(5)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,盐桥中的K+向(填“左侧”或“右侧”)烧杯移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如下图图1所示。已知金属单质的活动顺序为Al>Mn>Fe>Ni。回答下列问题:
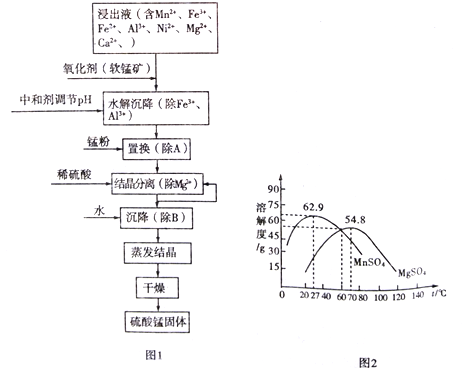
(1)用离子方程式表示加入“氧化剂(软锰矿)”作用:_________________________。
(2)已知:Ksp[Al(OH)3]=1.0×10-33 Ksp[Ni(OH)2]=1.6×10-15
Ksp[Mn(OH)2]=4.0×10-14 Ksp[Fe(OH)3]=2.6×10-39
“水解沉降”中:
①“中和剂”可以是__________(填标号)。
A.Al2O3 B.MgO C.H2SO4 D.MnO2
②溶液的pH应不低于______________。(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)
(3)“置换”的目的是____________________(用离子方程式表示)。
(4)“结晶分离”中的部分物质的溶解度曲线如上图图2所示。结晶与过滤过程中,体系温度均应维持在______________℃(填“27”、“60”或“70”)。
(5)“草酸钠一高锰酸钾返滴法”可测定软锰矿中MnO2的纯度(假设杂质不参与反应):取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1 mol/LNa2C2O4溶液(足量),最后用c2mol/L的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为________________________。
②该样品中MnO2的质量分数为______(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com