
【题目】Ⅰ.(1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
写出白磷(P4)由Ca3(PO4)2焦炭和SiO2在一定条件下反应的热化学方程式为: _____________。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)===SiF4(g)+2H2O(g) ΔH(298.15 K)=-94.0 kJ·mol-1 ΔS(298.15 K)=-75.8 J·mol-1·K-1,设ΔH和ΔS不随温度而变化,此反应自发进行的温度是_________
Ⅱ.(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨相比较, __________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=___。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 __________。
(2)已知:N2O2分子中化学键的键能分别是946 kJ/mol497 kJ/mol。N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ/mol。NO分子中化学键的键能为 _____________kJ/mol。
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:__________________________ 。
【答案】2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH=+2821.6kJ·mol-1 T<1.24×103K 石墨 393.5 kJ·mol-1 252.0 kJ 631.5 2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1
【解析】
Ⅰ.(1)根据已知的热化学方程式和盖斯定律进行计算;
(2)如果ΔG=ΔH-TΔS<0,则该反应能自发进行,据此计算温度的范围;
Ⅱ.(1)①由图象分析,金刚石能量高于石墨,结合物质的能量越低越稳定,比较二者的稳定性;石墨的燃烧热是指1mol石墨完全燃烧生成二氧化碳所放出的热量,结合图像进行计算;
②先根据生成气体的质量判断石墨燃烧的产物及其物质的量,再结合热化学方程式进行计算燃烧放出的热量;
(2)根据△H=反应物的键能总和生成物的键能总和计算NO分子中化学键的键能;;
(3)根据已知信息写出热化学方程式①C(石墨,s)+O2(g)=CO2(g) △H=393.5 kJ/mol;②C(石墨,s)+1/2O2(g)=CO(g) △H=110.5 kJ/mol;③N2(g)+O2(g)=2NO(g) △H=+180 kJ/mol;再利用盖斯定律写出目标热化学方程式。
Ⅰ.(1)已知白磷(P4)可由Ca3(PO4)2焦炭和SiO2在一定条件下反应获得,发生反应的化学方程式为:2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g),已知热化学方程式:①2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1;
②CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1;则目标方程式可由①+②×6得到,ΔH=+3359.26 kJ·mol-1+(-89.61 kJ·mol-1)×6=+2821.6kJ·mol-1,则热化学方程式为:2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH=+2821.6kJ·mol-1;
故答案为:2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH=+2821.6kJ·mol-1;
(2)如果ΔG=ΔH-TΔS<0,则该反应能自发进行,已知ΔH(298.15 K)=-94.0 kJ·mol-1,ΔS(298.15 K)=-75.8 J·mol-1·K-1,所以![]() ,则此反应自发进行的温度是T<1.24×103K;
,则此反应自发进行的温度是T<1.24×103K;
故答案为:T<1.24×103K;
Ⅱ.(1)①由图象分析,金刚石能量高于石墨,能量越低越稳定,所以石墨更稳定;1mol石墨完全燃烧生成1mol二氧化碳放出的热量为(110.5+283.0)kJ =393.5kJ,则石墨的燃烧热为393.5 kJ·mol-1;
故答案为:石墨;393.5 kJ·mol-1;
②12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳,质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,则生成的气体为一氧化碳和二氧化碳的混合气体,设一氧化碳物质的量为x mol,二氧化碳物质的量为(1x)mol,则可列方程式:28x+44(1x)=36,解得x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g) △H=393.5kJmol1;C(石墨,s)+1/2O2(g)═CO(g) △H=110.5kJmol1;生成二氧化碳和一氧化碳混合气体放出热量=393.5kJmol1×0.5mol+110.5 kJmol1×0.5mol=252.0kJ;则12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;
故答案为:252.0 kJ;
(2)△H=反应物的键能总和生成物的键能总和,即946kJ/mol+497kJ/mol2E(NO)=180.0kJ/mol,解得,E(NO)=631.5kJ/mol,则NO分子中化学键的键能为631.5kJ/mol;
故答案为:631.5;
(3)已知①C(石墨,s)+O2(g)=CO2(g) △H=393.5 kJ/mol;②C(石墨,s)+1/2O2(g)=CO(g) △H=110.5 kJ/mol;③N2(g)+O2(g)=2NO(g) △H=+180 kJ/mol;根据盖斯定律可得:方程式①×2②×2③得2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=746.0 kJ/mol;则用CO除去NO的热化学方程式:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1;
故答案为:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol·L-1CH3COONa溶液与0.1mol·L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1mol·L-1NH4Cl溶液与0.1mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合:![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1mol·L-1Na2C2O4溶液与0.1mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)![]() pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的![]() ,c(X)=0.5mol/L,下列说法正确的是( )
,c(X)=0.5mol/L,下列说法正确的是( )
A.反应向逆方向移动B.Y可能是固体或液体
C.系数n>mD.Z的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物![]() 如
如![]() 、
、![]() 、
、![]() 等
等![]() 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.
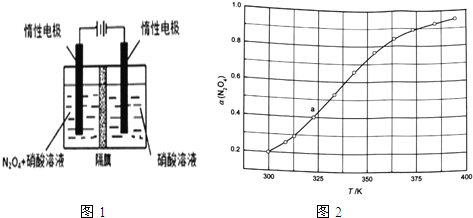
(1)从![]() 可通过电解或臭氧氧化
可通过电解或臭氧氧化![]() 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示![]() 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过![]() ,其阳极反应式为______.
,其阳极反应式为______.
已知:![]()
![]()
![]()
则反应![]() 的
的![]() ______.
______.
(2)从![]() 在一定条件下发生分解:
在一定条件下发生分解:![]() 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中![]() 浓度随时间的变化如下表:
浓度随时间的变化如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
设反应开始时体系压强为![]() ,第
,第![]() 时体系压强为p,则p:
时体系压强为p,则p:![]() ______;
______;![]() 内,
内,![]() 的平均反应速率为______.
的平均反应速率为______.
(3)从![]() 与
与![]() 之间存在反应
之间存在反应![]() 将一定量的
将一定量的![]() 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率![]() 随温度变化如图1所示.
随温度变化如图1所示.
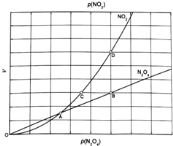
![]() 图中a点对应温度下,已知
图中a点对应温度下,已知![]() 的起始压强
的起始压强![]() 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数![]() ______
______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() .
.
![]() 由图推测
由图推测![]() 是吸热反应还是放热反应,说明理由______,若要提高
是吸热反应还是放热反应,说明理由______,若要提高![]() 转化率,除改变反应温度外,其他措施有______
转化率,除改变反应温度外,其他措施有______![]() 要求写出两条
要求写出两条![]() .
.
![]() 对于反应
对于反应![]() ,在一定条件下
,在一定条件下![]() 与
与![]() 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系:![]() ,
,![]() 其中,
其中,![]() 、
、![]() 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,![]() 、
、![]() 与平衡常数
与平衡常数![]() 的关系是
的关系是![]() ______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A. 同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B. BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C. BaSO4和BaCO3共存的悬浊液中, 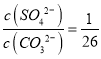
D. BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,在体积不变的密闭容器中,有可逆反应X(s)+2Y(g) ![]() 2Z(g) △H<0,下列说法—定正确的是
2Z(g) △H<0,下列说法—定正确的是
A. 0.2molX和0.4molY充分反应,Z的物质的量可能会达到0.35mol
B. 从容器中移出部分反应物X,则正反应速率将下降
C. 当△H不变时,反应将达到平衡
D. 向反应体系中继续通入足量Y气体,X有可能被反应完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
B. 反应H2S(g)+ZnO(s)===H2O(g)+ZnS(s)在一定条件下可自发进行,且ΔS<0,则ΔH>0
C. 常温常压,氢氧燃料电池工作消耗2.24 L O2时,转移电子的数目为0.4×6.02×1023
D. 常温下,Ksp[Cu(OH)2]=2.6×10-19,pH=10的含Cu2+的溶液中,c(Cu2+)≥2.6×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是

A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl![]() H2 + 2NaOH + ClCH2CH2Cl
H2 + 2NaOH + ClCH2CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 容器Ⅰ中发生反应的平衡常数为0.8 B. 容器Ⅱ中发生反应的起始阶段有v正>v逆
C. 达到平衡时,容器Ⅲ中![]() >1 D. 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
>1 D. 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com