
【题目】氮的氧化物![]() 如
如![]() 、
、![]() 、
、![]() 等
等![]() 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.
(1)从![]() 可通过电解或臭氧氧化
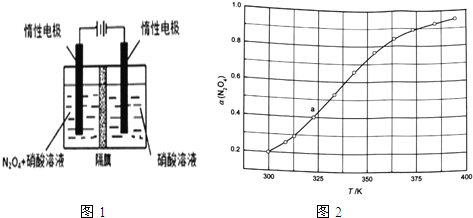
可通过电解或臭氧氧化![]() 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示![]() 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过![]() ,其阳极反应式为______.
,其阳极反应式为______.
已知:![]()
![]()
![]()
则反应![]() 的
的![]() ______.
______.
(2)从![]() 在一定条件下发生分解:
在一定条件下发生分解:![]() 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中![]() 浓度随时间的变化如下表:
浓度随时间的变化如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
设反应开始时体系压强为![]() ,第
,第![]() 时体系压强为p,则p:
时体系压强为p,则p:![]() ______;
______;![]() 内,
内,![]() 的平均反应速率为______.
的平均反应速率为______.
(3)从![]() 与
与![]() 之间存在反应
之间存在反应![]() 将一定量的
将一定量的![]() 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率![]() 随温度变化如图1所示.
随温度变化如图1所示.
![]() 图中a点对应温度下,已知
图中a点对应温度下,已知![]() 的起始压强
的起始压强![]() 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数![]() ______
______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() .
.
![]() 由图推测
由图推测![]() 是吸热反应还是放热反应,说明理由______,若要提高
是吸热反应还是放热反应,说明理由______,若要提高![]() 转化率,除改变反应温度外,其他措施有______
转化率,除改变反应温度外,其他措施有______![]() 要求写出两条
要求写出两条![]() .
.
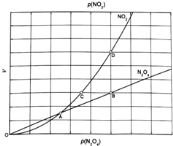
![]() 对于反应
对于反应![]() ,在一定条件下
,在一定条件下![]() 与
与![]() 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系:![]() ,
,![]() 其中,
其中,![]() 、
、![]() 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,![]() 、
、![]() 与平衡常数
与平衡常数![]() 的关系是
的关系是![]() ______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
【答案】![]()
![]()
![]()
![]()
![]() 吸热反应,温度升高,
吸热反应,温度升高,![]() 增加,说明平衡右移 减小体系压强、移出
增加,说明平衡右移 减小体系压强、移出![]()
![]() B点与D点 满足平衡条件
B点与D点 满足平衡条件![]()
【解析】
![]() 由
由![]() 制取
制取![]() 需要失去电子,所以
需要失去电子,所以![]() 在阳极区生成,
在阳极区生成,![]() 在阳极发生氧化反应失去电子生成
在阳极发生氧化反应失去电子生成![]() ;
;
![]()
![]()
![]()
![]()
将方程式![]() 得
得![]() ,焓变进行相应的改变;
,焓变进行相应的改变;
![]() 相同条件下,气体的物质的量之比等于其压强之比;
相同条件下,气体的物质的量之比等于其压强之比;
![]()
开始![]() 0 0
0 0
反应![]()
![]()
![]()
![]()
![]()
![]()
反应前后气体的压强之比等于其物质的量之比;
先计算五氧化二氮的反应速率,再根据同一时间段内各物质的反应速率之比等于其计量数之比计算氧气反应速率;
![]() 化学平衡常数
化学平衡常数![]() ;
;
![]() 升高温度平衡向吸热方向移动;减小体系压强、移出
升高温度平衡向吸热方向移动;减小体系压强、移出![]() 都使平衡正向移动;
都使平衡正向移动;
![]() 化学平衡常数
化学平衡常数![]() ,二者的反应速率之比等于其计量数之比;
,二者的反应速率之比等于其计量数之比;
满足平衡条件![]() 即为平衡点.
即为平衡点.
![]() 从电解原理来看,
从电解原理来看,![]() 制备
制备![]() 为氧化反应,则
为氧化反应,则![]() 应在阳极区生成,反应式为
应在阳极区生成,反应式为![]() ,
,
![]()
![]()
![]()
![]()
将方程式![]() 得
得![]() ,得
,得![]() ,
,
则该反应![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 相同条件下,气体的物质的量之比等于其压强之比;
相同条件下,气体的物质的量之比等于其压强之比;
![]()
开始![]() 0 0
0 0
反应![]()
![]()
![]()
![]()
![]()
![]()
反应前后气体的压强之比等于其物质的量之比,所以p:![]() :
:![]() ;
;
![]() ,再根据同一时间段内各物质的反应速率之比等于其计量数之比得氧气反应速率为
,再根据同一时间段内各物质的反应速率之比等于其计量数之比得氧气反应速率为![]()
![]() ,
,
故答案为:![]() ;
;![]()
![]() ;
;
![]() 四氧化二氮的转化率是
四氧化二氮的转化率是![]() ,设原来四氧化二的物质的量为xmol,转化的物质的量为
,设原来四氧化二的物质的量为xmol,转化的物质的量为![]() ,则混合气体的物质的量
,则混合气体的物质的量![]() ,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强
,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强![]() ,
,
四氧化二氮的分压![]()
二氧化氮的分压![]() ,
,
化学平衡常数![]() ,
,
故答案为:![]() ;
;
![]() 根据图知,升高温度转化率增大,升高温度平衡向吸热方向移动,则正反应是吸热反应,若要提高
根据图知,升高温度转化率增大,升高温度平衡向吸热方向移动,则正反应是吸热反应,若要提高![]() 转化率,除改变反应温度外,其他措施有减小体系压强、移出
转化率,除改变反应温度外,其他措施有减小体系压强、移出![]() ,
,
故答案为:吸热反应;温度升高,![]() 增加,说明平衡右移;减小体系压强、移出
增加,说明平衡右移;减小体系压强、移出![]() ;
;
![]() 化学平衡常数
化学平衡常数![]() ,二者的反应速率之比等于其计量数之比,
,二者的反应速率之比等于其计量数之比,
所以![]() :
:![]() :
:![]() :1,
:1,
化学平衡常数![]() ,
,
则![]() ,
,
满足平衡条件![]() 即为平衡点,BD点的压强之比等于其反应速率之比为1:2,所以BD为平衡点,
即为平衡点,BD点的压强之比等于其反应速率之比为1:2,所以BD为平衡点,
故答案为:![]() ;B点与D点,满足平衡条件
;B点与D点,满足平衡条件![]()


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式______________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物的化学式分别是________,其中最不稳定的是________。
(3)它们的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的化学式________,电子式________,结构式________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) 该反应为吸热反应。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) 该反应为吸热反应。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。

(1)t1时,正、逆反应速率的大小关系为ν正______ν逆(填“>”“<”或“=”);
(2)4分钟内,CO2的转化率为__________;CO的平均反应速率v(CO)=_________;
(3)下列条件的改变能减慢其反应速率的是______________(选填序号)
①降低温度 ②减少铁粉的质量
③保持压强不变,充入He使容器的体积增大
④保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是__________________(选填序号)
①v(CO2)=v(CO)
②单位时间内生成n molCO2的同时生成n mol CO
③ 容器中气体压强不随时间而变化
④容器中气体的平均分子量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
①氧化还原反应的实质是电子的得失。
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下。
③标准状况下,1 L HCl和1 L H2O的物质的量相同。
④溶于水得到的溶液可以导电的物质就是电解质。
⑤利用丁达尔现象区别溶液和胶体。
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同。
⑦在同温同体积时,气体物质的物质的量越大,则压强越大。
⑧同温同压下,气体的密度与气体的相对分子质量成正比。
A.①②③④B.②③⑥⑦⑧C.⑤⑦⑧D.④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
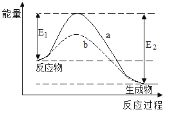
A.该反应为吸热反应
B.a与b相比,a的反应速率更快
C.a与b相比,反应的平衡常数一定不同
D.E2大于E1,说明总能量生成物比反应物低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
写出白磷(P4)由Ca3(PO4)2焦炭和SiO2在一定条件下反应的热化学方程式为: _____________。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)===SiF4(g)+2H2O(g) ΔH(298.15 K)=-94.0 kJ·mol-1 ΔS(298.15 K)=-75.8 J·mol-1·K-1,设ΔH和ΔS不随温度而变化,此反应自发进行的温度是_________
Ⅱ.(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨相比较, __________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=___。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 __________。
(2)已知:N2O2分子中化学键的键能分别是946 kJ/mol497 kJ/mol。N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ/mol。NO分子中化学键的键能为 _____________kJ/mol。
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:__________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度恒定的条件下,在2 L容积不变的密闭容器中,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
A.v(SO2)∶v(O2)=2∶1B.10 s内,v(SO3)=0.05 mol·L-1·s-1
C.SO2的平衡转化率为25%D.平衡时容器内的压强是反应前的5/6倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素和双氢青蒿素的结构如图所示
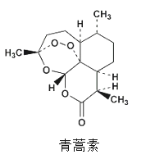

我国科学家屠呦呦和她的团队在低温、乙醚冷津条件下成功提取出青蒿素,科学家们又在一定条件下,用硼氢化钠(NaBH4)能将青蒿素选择性地还原为双氢青蒿素,从而大大提升了治疗疟疾的效果。下列有关分析错误的是
A.青蒿素属于内酯化合物,难溶于水,易溶于乙醚等有机溶剂
B.采用低温条件主要考虑青蒿素中的过氧键对热不稳定
C.等物质的量的青蒿素和双氢青蒿最多消耗NaOH的物质的量相等
D.青蒿素和双氢青蒿素每个分子中含有手性碳原子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com