
【题目】下列电解池电解一段时间后,加入相应的物质能使电解液恢复原浓度的是
A.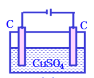 加氢氧化铜可以恢复B.
加氢氧化铜可以恢复B.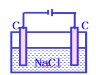 加盐酸可以恢复
加盐酸可以恢复
C.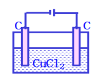 加入CuCl2固体可以恢复D.
加入CuCl2固体可以恢复D.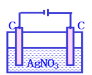 加硝酸银固体可以恢复
加硝酸银固体可以恢复
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2-氯-3-甲醛吲哚(如图所示)是重要的吲哚类衍生物,可作为有机合成的重要中间体,下列表达正确的是( )
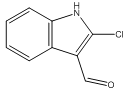
A.该分子的官能团为苯环、醛基、氯原子
B.它既可以发生取代反应,也可以发生氧化反应
C.1mol该物质与足量的氢气加成时共消耗氢气4mol
D.根据结构特征,推测该物质易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某原子的2p能级电子排布如图![]() ,该图违反了洪特规则
,该图违反了洪特规则
B.在[Ag(NH3)2]+离子中,Ag+给出孤对电子,NH3提供空轨道
C.科学上可以利用原子光谱上的特征谱线鉴定元素
D.基态铜原子的价电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A分子的球棍模型和B分子的比例模型,回答下列问题:

(1)A和B的关系是 。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式 。
(3)写出B分子和金属钠反应的化学方程式 。
(4)B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键__________。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有______(填序号)。
A.离子键 B.金属键
C.极性共价键 D.非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3![]() [Cu(NH3)4]2++2OH-。其原因是_________________。
[Cu(NH3)4]2++2OH-。其原因是_________________。
(3)Cu2+可以与乙二胺(H2N—CH2CH2—NH2)形成配离子:
 。
。
①H、O、N三种元素的电负性从大到小的顺序为___________。
②乙二胺分子中N原子成键时采取的杂化类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Glaser反应是指端炔烃在催化剂存在下可发生偶联反应,例如:
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
下面是利用Glaser反应制备化合物E的一种合成路线:
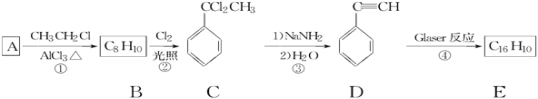
回答下列问题:
(1)B的结构简式为__,D的化学名称为__。
(2)步骤②的反应化学方程式:__。
(3)E的结构简式为__。用1molE合成1,4二苯基丁烷,理论上需要消耗氢气__mol。
(4)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢原子,数目比为3∶1,写出符合条件的两种F的结构简式___、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物:
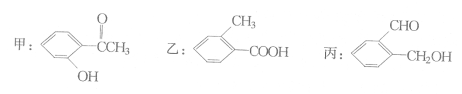
(1)请写出丙中含氧官能团的名称:___________________。
(2)请判别上述哪些有机物互为同分异构体:___________
(3)鉴别乙的方法(指明所选试剂及主要现象即可):__________
(4)请按酸性由强至弱排列甲、乙、丙的顺序:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A对氢气的相对密度为30,分子中含碳40%,含氢6.6%,其余为氧。
(1)通过计算确定该有机物的分子式;____
(2)按中学常见官能团,写出其可能的结构简式。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F、G、H 八种元素,均为前四周期元素,它们的原子序数依次增大。 请根据下列相关信息,回答有关问题。
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B 元素是形成化合物种类最多的元素
C 元素基态原子的核外 p 电子数比 s 电子数少 1
D 元素基态原子的核外 p 轨道中有两个未成对电子
E 元素的气态基态原子的第一至第四电离能分别是 I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F 元素的主族序数与周期数的差为 4
G 元素是前四周期中电负性最小的元素
H 元素位于元素周期表中的第八纵行
(1)C2A4 的电子式为___________________ (A、C 为字母代号,请将字母代号用元素符号表示,下同)。
(2)B 元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断 E 元素基态原子的核外电子排布图为 ![]() 。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是_________________________________________。
。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是_________________________________________。
(4)D、E、F 三种元素的简单离子半径由大到小的顺序是__________________(用离子符号表示)。
(5)用惰性电极电解 EF2 的水溶液的离子方程式为__________________________________________。
(6)H 位于元素周期表中__________区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验 H2+时产生蓝色沉淀,该反应的离子方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com