
【题目】现有 A、B、C、D、E、F、G、H 八种元素,均为前四周期元素,它们的原子序数依次增大。 请根据下列相关信息,回答有关问题。
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B 元素是形成化合物种类最多的元素
C 元素基态原子的核外 p 电子数比 s 电子数少 1
D 元素基态原子的核外 p 轨道中有两个未成对电子
E 元素的气态基态原子的第一至第四电离能分别是 I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F 元素的主族序数与周期数的差为 4
G 元素是前四周期中电负性最小的元素
H 元素位于元素周期表中的第八纵行
(1)C2A4 的电子式为___________________ (A、C 为字母代号,请将字母代号用元素符号表示,下同)。
(2)B 元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断 E 元素基态原子的核外电子排布图为 ![]() 。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是_________________________________________。
。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是_________________________________________。
(4)D、E、F 三种元素的简单离子半径由大到小的顺序是__________________(用离子符号表示)。
(5)用惰性电极电解 EF2 的水溶液的离子方程式为__________________________________________。
(6)H 位于元素周期表中__________区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验 H2+时产生蓝色沉淀,该反应的离子方程式为___________________________。
【答案】![]() 6 泡利原理 Mg原子失去2个电子后形成稳定结构,此时在失去1个电子很困难 Cl->O2->Mg2+ Mg2++2Cl+2H2O
6 泡利原理 Mg原子失去2个电子后形成稳定结构,此时在失去1个电子很困难 Cl->O2->Mg2+ Mg2++2Cl+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑ d 3d64s2 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
Mg(OH)2↓+Cl2↑+H2↑ d 3d64s2 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
【解析】
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,则A为H元素;
B元素是形成化合物种类最多的元素,可知B为C,可以形成多种有机物;
C元素原子的核外p电子数比s电子数少1,则C为N元素;
D元素基态原子的核外p轨道中有两个未成对电子,原子序数大于N,其电子排布为1s22s22p4,则D为O元素;
G元素是前四周期中电负性最小的元素,则G为K元素;
E原子的第一到第四电离能分别是:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol,说明E最外层有2个电子,其原子序数小于K,则E为Mg元素;
F元素的主族序数与周期数的差为4,其原子序数大于Mg,小于K,则F位于第三周期,最外层含有7个电子,为Cl元素;
H元素位于元素周期表中的第八列,为前四周期元素,且原子序数大于K,则H为Fe元素,据此解答。
(1)C2A4为N2H4,N2H4为共价化合物,其电子式为![]() ;
;
(2)B为C,其核外电子排布为1s22s22p2,共有6个电子,每个电子的运动状态各不相同,所以共有6种不同运动状态的电子;
(3)E为Mg,为12号元素,该同学所画电子排布图中3s轨道有2个自旋方向相同的电子,违背了泡利不相容原理;Mg原子失去2个电子后形成稳定结构,此时在失去1个电子很困难,所以I3 远远大于 I2;
(4)电子层越多离子半径越大,电子层相同时,核电荷数越大离子半径越小,则离子半径大小为:Cl->O2->Mg2+;
(5)用惰性电极电解MgCl2的水溶液,阳极氯离子放电,阴极水电离的氢离子放电,同时产生的氢氧根与镁离子会生成沉淀,该反应的离子方程式为:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑;
Mg(OH)2↓+Cl2↑+H2↑;
(6)H为Fe元素,位于元素周期表中的d区,Fe元素的原子序数为26,其基态原子的价电子排布式为3d64s2;实验室用铁氰化钾溶液检验Fe2+,产生蓝色沉淀,该反应的离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓。


科目:高中化学 来源: 题型:
【题目】下列电解池电解一段时间后,加入相应的物质能使电解液恢复原浓度的是
A.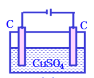 加氢氧化铜可以恢复B.
加氢氧化铜可以恢复B.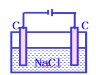 加盐酸可以恢复
加盐酸可以恢复
C.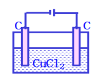 加入CuCl2固体可以恢复D.
加入CuCl2固体可以恢复D.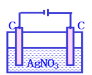 加硝酸银固体可以恢复
加硝酸银固体可以恢复
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁片镀铜实验中(装置如下图所示),为提高电镀效果,电镀前铁片需依次用NaOH溶液、稀盐酸和水洗涤。下列说法不正确的是
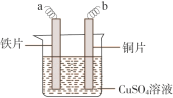
A.稀盐酸的主要作用是除去铁锈
B.a接电源正极,b接电源负极
C.电镀过程中c(Cu2+)基本保持不变
D.阴极发生反应:Cu2++2e– = Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2冲入10L恒温密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH═-196kJ/mol,5min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A.0~5min内,用O2表示的平均反应速率υ(O2)═0.017mol·(L·min)-1
B.条件不变,起始时向容器中冲入4molSO2和2molO2,平衡时反应放热小于333.2kJ
C.若增大O2的浓度,则SO2的转化率增大
D.![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中的位置为_____________,NF3的分子立体构型名称是____________。类比NH3·H2O表示出代表性分子NH4F含有的氢键________________________。
(2)写出N2O的等电子体__________________(1个分子和1个离子)。
(3)Cu原子的基态外围电子排布式为____________;已知:CuO在高温下会分解成Cu2O,试从洪特规则角度解释其原因__________________________________________________。
(4) 在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中H—C=O的键角______(填“大于”“等于”或“小于”)乙醇分子中的H—C—O的键角。
(5) 某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。其水溶液中的N4H44+遇碱生成一种形似白磷的N4分子。画出N4H44+的结构式(标明其中的配位键)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列是________。
①0.5 mol氨气
②标准状况下22.4 L氦气
③4 ℃时9 mL水
④0.2 mol磷酸钠(Na3PO4)
(2)现有m g某气体,它是三原子分子,其摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
④该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。
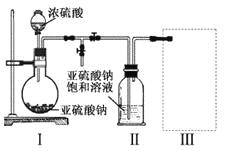
(1)装置I中产生气体的化学方程式为:_________________________________;
(2)要从装置II中获得已析出的晶体,可采取的分离方法是__________________;
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。
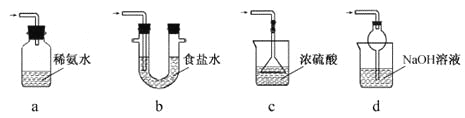
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3B.6∶3∶2C.3∶1∶1D.1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
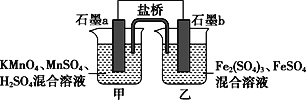
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com