
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中的位置为_____________,NF3的分子立体构型名称是____________。类比NH3·H2O表示出代表性分子NH4F含有的氢键________________________。
(2)写出N2O的等电子体__________________(1个分子和1个离子)。
(3)Cu原子的基态外围电子排布式为____________;已知:CuO在高温下会分解成Cu2O,试从洪特规则角度解释其原因__________________________________________________。
(4) 在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中H—C=O的键角______(填“大于”“等于”或“小于”)乙醇分子中的H—C—O的键角。
(5) 某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。其水溶液中的N4H44+遇碱生成一种形似白磷的N4分子。画出N4H44+的结构式(标明其中的配位键)__________________。
【答案】第二周期第VA族 三角锥形 N—H···F(或F—H···N) CO2(或CS2、COS、BeCl2(g))和N3—(NO2+、SCN—) 3d104s1 Cu+价电子排布式为3d10,为全充满结构,能量较低,较稳定 大于 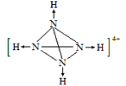
【解析】
(1)N元素为7号元素,位于第二周期第VA族;NF3的中心原子价层电子对数为![]() =4,含一对孤对电子,所以空间构型为三角锥形;NH4F含有的氢键可以表示为N—H···F(或F—H···N);
=4,含一对孤对电子,所以空间构型为三角锥形;NH4F含有的氢键可以表示为N—H···F(或F—H···N);
(2)N2O原子数为3,价电子数为5×2+6=16,原子总数相同,价电子总数相同的分子或离子为等电子体,所以其等电子体有CO2(或CS2、COS、BeCl2(g))和N3-(或NO2+、SCN-);
(3)铜原子为29号元素,根据电子排布规律可知其基态原子的外围电子排布为3d104s1;Cu+价电子排布式为3d10,为全充满结构,能量较低,较稳定,所以CuO在高温下会分解成Cu2O;
(4)醛基中碳原子采用sp2杂化,为平面三角形构型,乙醇中含有醇羟基的碳原子采用sp3杂化,为四面体构型,所以乙醛分子中H-C=O的键角大于乙醇分子中的H-C-O的键角;
(5)白磷分子为正四面体形,四个磷原子占据四个顶点,N4分子与白磷分子结构相似,说明N4分子中每个氮原子均形成3个σ键,所以在N4H44+中氢离子和N原子形成配位键,遇碱后配位键断裂形成N4,所以N4H44+的结构式应为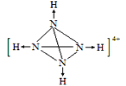 。
。


科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键__________。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有______(填序号)。
A.离子键 B.金属键
C.极性共价键 D.非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3![]() [Cu(NH3)4]2++2OH-。其原因是_________________。
[Cu(NH3)4]2++2OH-。其原因是_________________。
(3)Cu2+可以与乙二胺(H2N—CH2CH2—NH2)形成配离子:
 。
。
①H、O、N三种元素的电负性从大到小的顺序为___________。
②乙二胺分子中N原子成键时采取的杂化类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项 | 微粒组 | 所加试剂 | 离子方程式 |
A | NH | 少量Ba(OH)2溶液 | 2NH |
B | Mg2+、Cl-、HCO | 过量NaOH溶液 | Mg2++2HCO |
C | Fe2+、NO | NaHSO4溶液 | HSO |
D | K+、CO | 通入少量CO2 | CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属.试回答:
(1)B在周期表中的位置是_________ ; C的元素名称为______.
(2)在五种元素中,能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是______ (用具体的分子式表示).
(3)A与B形成的三原子分子的结构式是______,B与D形成的原子个数比为1:1的化合物的电子式是______.
(4)写一个由以上5种元素中部分元素形成的物质的发生置换反应的方程式_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
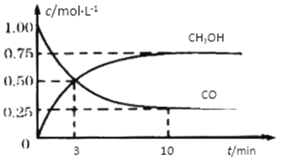
A.反应的化学方程式:CO+2H2![]() CH3OH
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 A、B、C、D、E、F、G、H 八种元素,均为前四周期元素,它们的原子序数依次增大。 请根据下列相关信息,回答有关问题。
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B 元素是形成化合物种类最多的元素
C 元素基态原子的核外 p 电子数比 s 电子数少 1
D 元素基态原子的核外 p 轨道中有两个未成对电子
E 元素的气态基态原子的第一至第四电离能分别是 I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F 元素的主族序数与周期数的差为 4
G 元素是前四周期中电负性最小的元素
H 元素位于元素周期表中的第八纵行
(1)C2A4 的电子式为___________________ (A、C 为字母代号,请将字母代号用元素符号表示,下同)。
(2)B 元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断 E 元素基态原子的核外电子排布图为 ![]() 。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是_________________________________________。
。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是_________________________________________。
(4)D、E、F 三种元素的简单离子半径由大到小的顺序是__________________(用离子符号表示)。
(5)用惰性电极电解 EF2 的水溶液的离子方程式为__________________________________________。
(6)H 位于元素周期表中__________区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验 H2+时产生蓝色沉淀,该反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式为:
(1)写出咖啡酸中两种含氧官能团的名称:______________、____________。
(2)根据咖啡酸的结构,列举咖啡酸可以发生的三种反应类型:________、________、________。
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为________。
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117 g NaCl溶于水配制成1 L溶液。
(1)该溶液中NaCl的物质的量浓度为________,溶液中Cl-的物质的量浓度为________。
(2)配制1 mol·L-1的NaCl溶液500 mL,需该溶液的体积为________。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为________,通入HCl气体的体积(标准状况下)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。则A的相对分子质量为:___。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为:___。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。用结构简式表示A中含有的官能团为:___、__。
(4)A的核磁共振氢谱如图:则A中含有___种氢原子。
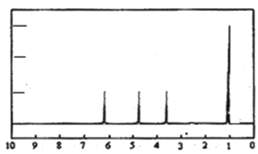
(5)综上所述,A的结构简式为___,跟NaHCO3溶液反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com