
【题目】A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属.试回答:
(1)B在周期表中的位置是_________ ; C的元素名称为______.
(2)在五种元素中,能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是______ (用具体的分子式表示).
(3)A与B形成的三原子分子的结构式是______,B与D形成的原子个数比为1:1的化合物的电子式是______.
(4)写一个由以上5种元素中部分元素形成的物质的发生置换反应的方程式_____.
【答案】第二周期第VIA族 硅 H2O>NH3>CH4>SiH4 O=C=O ![]() 2C + SiO2
2C + SiO2 ![]() 2CO↑ + Si
2CO↑ + Si
【解析】
A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族。 C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属,则D的最外层有1个电子,其为Na,C的最外层有4个电子,其为Si ,则A为C元素;C原子核内质子数等于A、B原子核内质子数之和,则B为O元素;原子半径A>E>B,则E为N元素。
(1)B为O元素,其在周期表中的位置是第二周期第VIA族; C的元素名称为硅。
(2)在五种元素中,能形成的最简单的液态或气态氢化物的有H2O、NH3、CH4、SiH4,由于非金属性O>N>C>Si,故其稳定性由大到小的顺序是H2O>NH3>CH4>SiH4。
(3)A与B形成的三原子分子是CO2,其分子中有两个碳氧双键,故其结构式是O=C=O,B与D形成的原子个数比为1:1的化合物是过氧化钠,其电子式是![]() 。
。
(4)由以上5种元素中部分元素形成的物质中,能发生置换反应的有多种,如钠和水、氨气和氧气、甲烷和氧气(甲烷不完全燃烧生成碳的单质)、焦炭和二氧化硅,焦炭和二氧化硅反应的化学方程式为2C + SiO2 ![]() 2CO↑ + Si 。
2CO↑ + Si 。


科目:高中化学 来源: 题型:
【题目】I如图所示是分离混合物时常用的仪器,回答下列问题:
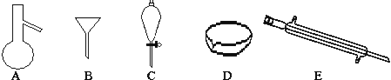
(1)写出仪器A、E的名称______、______。
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符)
①粗盐和泥沙:______;②花生油和水:______。
(3)下列关于仪器的使用说法正确的是______。
①A仪器可以用酒精灯直接加热
②B仪器可以用于向酒精灯中添加酒精
③C仪器在放出液体时应打开上边的玻璃塞,或使塞上的凹槽(或小孔)对准漏斗上的小孔,再拧开下面的活塞,使下层液体慢慢流出
④在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
⑤E仪器中水的流向是上进下出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象______。
II.某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图填空,完成回收硫酸亚铁和铜的简单实验方案(成分A、B、C、D既可能是纯净物也可能是混合物)。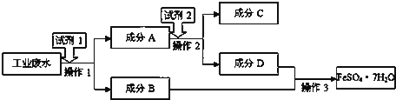
(1)试剂1为______(填化学名称,下同),试剂2为______。
(2)成分A为______。
(3)操作1、2是同一分离操作,操作名称为______,所需的玻璃仪器为______。
(4)加入试剂1所涉及的反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池有稳定性高、安全、环境友好等优点。电池反应为FePO4+Li![]() LiFePO4:电池正极材料为LiFePO4,负极材料是石墨烯和锂,含Li+导电固体为电解质,下列有关此电池说法正确的是
LiFePO4:电池正极材料为LiFePO4,负极材料是石墨烯和锂,含Li+导电固体为电解质,下列有关此电池说法正确的是
A.放电时正极反应为FePO4 + Li+ +e- = LiFePO4B.放电时电池内部Li+向负极移动
C.放电过程中,电池负极材料质量增加D.可加入稀硫酸以提高电解质的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁片镀铜实验中(装置如下图所示),为提高电镀效果,电镀前铁片需依次用NaOH溶液、稀盐酸和水洗涤。下列说法不正确的是
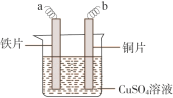
A.稀盐酸的主要作用是除去铁锈
B.a接电源正极,b接电源负极
C.电镀过程中c(Cu2+)基本保持不变
D.阴极发生反应:Cu2++2e– = Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2冲入10L恒温密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH═-196kJ/mol,5min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A.0~5min内,用O2表示的平均反应速率υ(O2)═0.017mol·(L·min)-1
B.条件不变,起始时向容器中冲入4molSO2和2molO2,平衡时反应放热小于333.2kJ
C.若增大O2的浓度,则SO2的转化率增大
D.![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中的位置为_____________,NF3的分子立体构型名称是____________。类比NH3·H2O表示出代表性分子NH4F含有的氢键________________________。
(2)写出N2O的等电子体__________________(1个分子和1个离子)。
(3)Cu原子的基态外围电子排布式为____________;已知:CuO在高温下会分解成Cu2O,试从洪特规则角度解释其原因__________________________________________________。
(4) 在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中H—C=O的键角______(填“大于”“等于”或“小于”)乙醇分子中的H—C—O的键角。
(5) 某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。其水溶液中的N4H44+遇碱生成一种形似白磷的N4分子。画出N4H44+的结构式(标明其中的配位键)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。
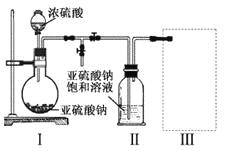
(1)装置I中产生气体的化学方程式为:_________________________________;
(2)要从装置II中获得已析出的晶体,可采取的分离方法是__________________;
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。
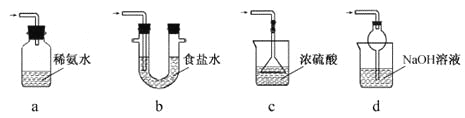
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应Al2O3+N2+3C ![]() 2AlN+3CO的叙述正确的是
2AlN+3CO的叙述正确的是
A. Al2O3是氧化剂,C是还原剂 B. 每生成1 mol CO需转移2 mol电子
C. AlN中氮元素的化合价为+3 D. N2发生了氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com