
����Ŀ��ij��ѧ��ȤС����̽���������ʵ����ʼ��Ʊ���
��̽��һ��ѡ�������װ�ú�ҩƷ̽��������������������ǿ����
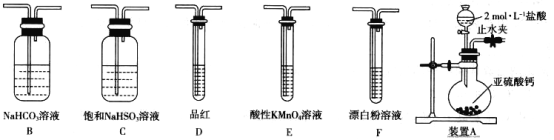
��1��װ��A��ʢ����IJ�������������____________��װ��A�з�Ӧ�����ӻ�ѧ����ʽΪ_______________________________��
��2��װ������˳��ΪA��________________������װ��C��������_________��ͨ������___________________________������֤�������������ǿ�ڴ����ᡣ
��̽��������������ƾ��壨Na2S2O3��5H2O,M=248g/mol����������Ӱ������ԭ�����ش��������⣺
��3������K2Cr2O7����Һ�����ⶨ��������ƵĴ��ȡ��ⶨ�������£�
����Һ���ƣ���ȡ1.2000 gij��������ƾ�����Ʒ��������в���ȴ������ˮ��__________���ܽ⣬��ȫ�ܽ��ȫ��ת����100mL_________�У��ٶ�������Һ����̶�����ƽ��
�ڵζ���ȡ0.00950 mol��L1��K2Cr2O7����Һ20.00 mL�������ữ��������KI��������Ӧ�� Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O��Ȼ���������������Ʒ��Һ�ζ���������ɫ��������Ӧ��I2+2S2O32
3I2+2Cr3++7H2O��Ȼ���������������Ʒ��Һ�ζ���������ɫ��������Ӧ��I2+2S2O32![]() S4O62+2I�����������Һ��Ϊָʾ���������ζ�����_______________��Ϊ�յ㡣ƽ�еζ�3�Σ���Ʒ��Һ��ƽ������Ϊ24.80 mL������Ʒ����Ϊ_________%������1λС������
S4O62+2I�����������Һ��Ϊָʾ���������ζ�����_______________��Ϊ�յ㡣ƽ�еζ�3�Σ���Ʒ��Һ��ƽ������Ϊ24.80 mL������Ʒ����Ϊ_________%������1λС������
��4��Na2S2O3���������ȼ�������Һ���ױ���������ΪSO42-���÷�Ӧ�����ӷ���ʽΪ____________________________________��
���𰸡�Բ����ƿ CaSO3+2H+=Ca2++SO2��+H2O CBEDF ��ȥHCl���� װ��D��Ʒ����Һ����ɫ��F�г��ְ�ɫ���� �ձ� ����ƿ �������һ�������������Һ����Һ��ɫ��ȥ���Ұ���Ӻ�ԭ 95.0 S2O32-+4Cl2+5H2O�T2SO42-+8Cl-+10H+
��������
��1��װ��A��ʢ��������Ƶ���������ΪԲ����ƿ��Բ����ƿ�з����ķ�ӦΪCaSO3�����ᷴӦ�Ʊ�SO2��
��2��HClO����ǿ�����ԣ�SO2���л�ԭ�ԣ����߿ɷ���������ԭ��Ӧ����˲�������SO2����������Һ��Ӧ�Ƚ�HClO��H2SO3������ǿ��������֤��H2SO3������ǿ��H2CO3���ٽ��H2CO3������ǿ��HClO���бȽϡ�Aװ�������Ʊ�SO2�����������ӷ���Aװ���Ʊ��������л���HCl���壬ѡ�ñ���NaHSO3��Һ��ȥHCl����ͨ��NaHCO3��Һ��������֤H2SO3������ǿ��H2CO3��������KMnO4��Һ��ȥCO2�е�SO2����Ʒ����Һ����CO2�е�SO2����������ͨ��Ư����Һ�У�������ɫ����������֤��H2CO3������ǿ��HClO���ݴ˻ش�������⡣
��3��������һ�����ʵ���Ũ�ȵ���Һ�IJ���������з�����
�ڵ��������������Һ����ɫ�����������������Һ��Ϊָʾ���������ζ����ⲻ�ϱ����������������һ�������������Һ����Һ��ɫ��ȥ���Ұ���Ӻ�ԭ����Ϊ�յ㣻����Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O��I2+2S2O32
3I2+2Cr3++7H2O��I2+2S2O32![]() S4O62+2I��֪��Cr2O72--3I2--6S2O32�������n(S2O32),�Ӷ��������m(Na2S2O3��5H2O)�������Ʒ������
S4O62+2I��֪��Cr2O72--3I2--6S2O32�������n(S2O32),�Ӷ��������m(Na2S2O3��5H2O)�������Ʒ������
��4��Na2S2O3����������ΪSO42-����������ԭΪCl-���ݴ�д����Ӧ�����ӷ���ʽ��
��1��װ��A��ʢ��������Ƶ���������ΪԲ����ƿ��Բ����ƿ�з����ķ�ӦΪCaSO3�����ᷴӦ�Ʊ�SO2����ѧ����ʽΪCaSO3+2H+=Ca2++SO2��+H2O������������������ǣ�Բ����ƿ��CaSO3+2H+=Ca2++SO2��+H2O��
��2��HClO����ǿ�����ԣ�SO2���л�ԭ�ԣ����߿ɷ���������ԭ��Ӧ����˲�������SO2����������Һ��Ӧ�Ƚ�HClO��H2SO3������ǿ��������֤��H2SO3������ǿ��H2CO3���ٽ��H2CO3������ǿ��HClO���бȽϡ�Aװ�������Ʊ�SO2�����������ӷ���Aװ���Ʊ��������л���HCl���壬ѡ�ñ���NaHSO3��Һ��ȥHCl����ͨ��NaHCO3��Һ��������֤H2SO3������ǿ��H2CO3��������KMnO4��Һ��ȥCO2�е�SO2����Ʒ����Һ����CO2�е�SO2����������ͨ��Ư����Һ�У�������ɫ����������֤��H2CO3������ǿ��HClO����ˣ�װ�õ�����˳��ΪACBEDF��������Ϸ�����֪��װ������װ��C�������dz�ȥHCl���壻���ݷ�����֪֤�������������ǿ�ڴ����������ΪD��Ʒ����Һ����ɫ��F�г��ְ�ɫ����������������������ǣ�CBEDF�� ��ȥHCl���壻װ��D��Ʒ����Һ����ɫ��F�г��ְ�ɫ������
��3��������һ�����ʵ���Ũ�ȵ���Һ����ȡ����������ƾ�����Ʒ��������в���ȴ������ˮ���ձ����ܽ⣬��������ֽ��裬��ȫ�ܽ��ȫ��ת����100mL����ƿ�У��ٶ�������Һ����̶�����ƽ������������������ǣ��ձ�������ƿ��
�ڵ��������������Һ����ɫ�����������������Һ��Ϊָʾ���������ζ����ⲻ�ϱ����������������һ�������������Һ����Һ��ɫ��ȥ���Ұ���Ӻ�ԭ����Ϊ�յ㣻����Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O��I2+2S2O32
3I2+2Cr3++7H2O��I2+2S2O32![]() S4O62+2I��֪��Cr2O72--3I2--6S2O32������n(K2Cr2O7)= 0.00950��20.00��10-3mol,��n(Na2S2O3)= 6��0.00950��20.00��10-3mol,m(Na2S2O3)=6��0.00950��20.00��10-3��248g,��������Ʒm(Na2S2O3��5H2O)����Ϊ[6��0.00950��20.00��10-3��248����100/24.8��]/1.2000��100%=95.0%��
S4O62+2I��֪��Cr2O72--3I2--6S2O32������n(K2Cr2O7)= 0.00950��20.00��10-3mol,��n(Na2S2O3)= 6��0.00950��20.00��10-3mol,m(Na2S2O3)=6��0.00950��20.00��10-3��248g,��������Ʒm(Na2S2O3��5H2O)����Ϊ[6��0.00950��20.00��10-3��248����100/24.8��]/1.2000��100%=95.0%��
��������������������������һ�������������Һ����Һ��ɫ��ȥ���Ұ���Ӻ�ԭ ��95.0��
��4��Na2S2O3���������ȼ�������Һ���ױ���������ΪSO42-����������ԭΪCl-���÷�Ӧ�����ӷ���ʽΪS2O32-+4Cl2+5H2O�T2SO42-+8Cl-+10H+���������������������S2O32-+4Cl2+5H2O�T2SO42-+8Cl-+10H+��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ��Ӧ���л��ϳ������벻���ͼ��ij���;������±�����ʹ�������һ���ʡ�
��1��һ�������²���±������±�������ˮ����Ӧ���P��������±���
±������ | ��Ӧ���P����� |
|
81% 19% |
|
80% 20% |
|
80% 20% |
|
90% 10% |
�����������ݣ��õ�±�����ʹ�������ȥ��Ӧʱ����λ���������Ҫ������_________��
��2���о�һ�����ܷ�����ȥ��Ӧ�Ĵ���д���ṹ��ʽ��_______________________________��
��3����֪��Ũ�������������ˮ����������˳-2-��ϩ(ռ25%)�ͷ�-2-��ϩ(ռ75%)���֡�д��2-��ϩ��˳ʽ�ṹ��_______________________________��
��4����������2-������ϳ�Ȳ��C�ķ�Ӧ���̣�
![]()
A�Ľṹ��ʽΪ_________________��C�Ľṹ��ʽΪ___________________�������еķ�Ӧ������ȥ��Ӧ����___________(����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C���������о�����ͬһ��Ԫ�أ�����֮��������ͼ��ʾ��ת����ϵ�����ַ�Ӧ��������ȥ������˵������ȷ����
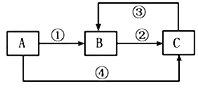
A. ��A��һ�������������B��ˮ��Һ�ɳ����ԣ�C��ˮ��Һ�ɳʼ���
B. ��A��һ�ֽ������ʣ���Ӧ�٢ڢ۾���Ϊ���Ϸ�Ӧ����Ӧ�ܿ�Ϊ�û���Ӧ
C. ��A��B���ǿ�ȼ�����ʣ���ȫȼ�ն���������C��������A��ҺPH<7����Cͨ��A��Һ�У�pH�ȼ�С������
D. ��A��B��C�����ֲ�ͬ���Ĺ������ʣ���B�����ǹ�ҵ����ȡA��C��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ��X��Y��Z��W���������������ˮ�ɵ�������Һ��0.010 mol/L����������ҺpH���Ԫ��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
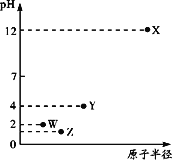
A. �����Ӱ뾶��X��Y��Z��W
B. YԪ�ش���ͬ��������
C. ��̬�⻯����ȶ��ԣ�Z��W��Y
D. X��Y������������Ӧ��ˮ����ǡ���к�ʱ����Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦNH4HS(s)![]() NH3(g)��H2S(g)��ij�¶��´ﵽƽ�⣬���и�������У�����ʹƽ�ⷢ���ƶ�����(����)
NH3(g)��H2S(g)��ij�¶��´ﵽƽ�⣬���и�������У�����ʹƽ�ⷢ���ƶ�����(����)
A. �¶ȡ��ݻ�����ʱ��ͨ��SO2���� B. ����һ����NH4HS����
C. �����������СΪԭ����һ�� D. ����ѹǿ���䣬���뵪��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ֹ�̬�����ۻ�����������ʱ���˷������������������ͬ�����͵��ǣ� ��
A.��͵⻯��B.���ʯ�ʹ���ʯ
C.����������D.�ɱ��Ͷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��5��5�գ��й�������ɻ�C919�ɳɹ���Ϊ�˼�������������ɻ�ijЩ����ʹ����þ�Ͻ�
��1����̬þԭ�Ӻ�����ӵĹ������ʽΪ___________���������_________��������ͬ�ĵ��ӡ�
��2���ٵڶ������ܣ�Na_______Mg(���������������)����ԭ��Ϊ______________��
�����ȶ��ԣ�CaCO3��MgCO3����ԭ��Ϊ___________________________��
��3��þ�����ڹ�ҵ��������;�㷺��Ҳ�Ƕ�ֲ��������бز����ٵ���Ԫ�أ���ͼΪҶ���صĽṹʾ��ͼ��

��ͼ����Mg�γ���λ����Nԭ�ӵı��Ϊ________����д����������������
��Ҷ�����У�̼ԭ�ӵ��ӻ���ʽΪ________��
��4��̼��þ��һ���ڻ�����ҵ��;�㷺�Ľ���̼���ij��̼��þ�ľ���ṹ��ͼ1��ʾ��ͼ2Ϊ�丩��ͼ��

�پ�����Mg����λ��Ϊ________��
����֪����٤��������ֵΪNA����ͼ1�м����̼��þ���ܶ�Ϊ________g��cm-3.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(H2NNH2)��һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯����ͼ��ʾ����֪����1 mol��ѧ�����������(kJ)��N��NΪ942��O=OΪ500��N��NΪ154�������1 mol N��H�����������(kJ)�ǣ�

A. 194 B. 391 C. 516 D. 658
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijԭ���ڴ����������״̬ʱ����Χ�����Ų�Ϊ3d14s2��������˵����ȷ����
A.��Ԫ��ԭ�Ӵ����������״̬ʱ��ԭ���й���3��δ�ɶԵ���
B.��Ԫ��ԭ�Ӻ����4���ܲ�
C.��Ԫ��ԭ�ӵ�M�ܲ㹲��8������
D.��Ԫ��ԭ������㹲��3������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com