
【题目】下图为直流电源电解稀Na2SO4溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )

A.一电极逸出无味气体,另一电极逸出刺激性气味气体
B.逸出气体的体积,a电极的大于b电极的
C.a电极附近呈红色,b电极附近呈蓝色
D.a、b电极附近均呈红色
【答案】B
【解析】
电解池中,石墨作电极,a极连接电源的负极,为电解池的阴极,b极连接电源的正极,为电解池的阳极,阳极反应式为:2H2O-4e- ═4H++O2↑,阴极反应式为: 2H2O+2e-═H2↑+2OH-,总反应为2H2O![]() 2H2↑+O2↑,电解Na2SO4溶液实质为电解水,据此解答。
2H2↑+O2↑,电解Na2SO4溶液实质为电解水,据此解答。
电解池中,石墨作电极,a极连接电源的负极,为电解池的阴极,b极连接电源的正极,为电解池的阳极,阳极反应式为:2H2O-4e- ═4H++O2↑,阴极反应式为: 2H2O+2e-═H2↑+2OH-,总反应为2H2O![]() 2H2↑+O2↑,电解Na2SO4溶液实质为电解水,
2H2↑+O2↑,电解Na2SO4溶液实质为电解水,
A. 氧气和氢气都是无色无味的气体,不可能逸出刺激性气味气体,A项错误;
B. a电极逸出的气体为氢气,b电极逸出的气体为氧气,二者关系为2H2O2,则相同条件下,气体的体积为a电极的大于b电极的,B项正确;
C. 由以上分析知,a电极是阴极,产生氢气,同时产生氢氧根离子,呈碱性,石蕊溶液呈蓝色;b电极是阳极,产生氧气,同时产生氢离子,所以b极区呈酸性,石蕊溶液呈红色,C项错误;
D. 由C项分析知,a电极附近呈蓝色,b电极附近呈红色,D项错误;
答案选B。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量g/100ml![]() 。
。
(1)量取10.00ml食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用___(填仪器名称)取待测白醋溶液20.00ml于锥形瓶中,向其中滴加2滴酚酞。
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___mL。滴定终点的现象:___,停止滴定,记录NaOH溶液的终读数,计算实验所用NaOH溶液总体积记录于下表,重复滴定4次。
![]()
(4)实验记录数据(ml)
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)数据处理与讨论:
A.甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积__ml,按正确数据处理,可得市售白醋总酸量![]() __g/100ml。
__g/100ml。
B.在本实验的滴定过程中,下列操作对实验结果的影响是(填写“偏大”、“偏小”或“无影响”)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗___;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失___;
c.锥形瓶中加入待测白醋溶液后,再加少量水___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3Cl)一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等有机浓剂。
(1)甲组同学在实验室用装置A模拟催化法制备一氯甲烷并检验CH3Cl的稳定性。
A. 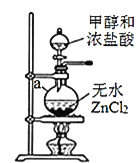 B.
B. 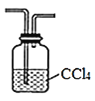 C.
C. 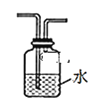 D.
D. 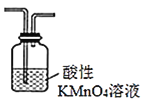
①装置A中仪器a的名称为__________,a瓶中发生反应的化学方程式为________。
②实验室干燥ZnCl2晶体制备无水ZnCl2的方法是________。
(2)为探究CH3Cl与CH4分子稳定性的差别,乙组同学设计实验验证CH3C1能被酸性KMnO4溶液氧化。
①为达到实验目的,上面装置图中装置连接的合理顺序为A________
②装置中水的主要作用是__________。
③若实验过程中还产生了一种黄绿色气体和一种无色气体,该反应的离子方程式为_____。
(3)丙组同学选用A装置设计实验探究甲醇的转化率。取6.4g甲醇与足量的浓盐酸充分反应,将收集到的CH3Cl气体在足量的氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收。现以甲基橙作指示剂,用c2mol·L-1盐酸标准溶液对吸收液进行返滴定,最终消耗V2mL盐酸。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
①滴定终点的现象为____________
②该反应甲醇的转化率为________。(用含有V、c的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.已知冰的熔化热为 6.0kJ·mol-1,冰中氢键键能为 20 kJ·mol-1,若熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15 %的氢键
B.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1 ,则该反应正反应活化能比逆反应活化能大100 kJ·mol-1
C.甲烷的标准燃烧热为890.3 kJ·mol-1,则 1molCH4 发生反应CH4(g)+2O2(g)=CO2 (g) + 2H2O (g) 放出的热量小于 890.3 kJ·mol-1
D.500 ℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成 NH3 (g),放出量热 19.3 kJ,其热化学方程式可表示为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )

A.在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为92kJ
B.a曲线是加入催化剂时的能量变化曲线,催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
C.催化剂,能增大有效碰撞次数,但不能提高N2的转化率
D.该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1234.8kJ·mol-1
结论:C2H5OH的燃烧热 △H=-1234.8 kJ·mol-1
B. 稀溶液中有H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
结论:将稀醋酸与NaOH的稀溶液混合后,若有1 mol H2O生成,则放出的能量等于57.3kJ
C. C(s,石墨)=C(s,金刚石) △H=+1.5kJ·mol-1
结论:相同条件下金刚石比石墨稳定
D. Sn(s,灰)![]() Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
结论:锡制品在寒冷的冬天更容易损坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
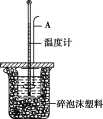
(1)理论上强酸强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)则中和热ΔH= _____________(取小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaO溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水资源可以制备氯化铵、纯碱、金属镁等物质,其流程如下:

(1)反应①~⑤中,属于氧化还原反应的是______________(填序号)。
(2)写出反应②的离子方程式__________________________________________________。
(3)X溶液中的主要阳离子是Na+和____________。
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③_____;④加适量盐酸;⑤_____(请补全缺少的实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则表示CH4燃烧热的热化学方程式是_______________________。
(2)已知:C(s) + O2(g)![]() CO2(g) ΔH1 =-437.3 kJmol-1
CO2(g) ΔH1 =-437.3 kJmol-1
2H2(g) + O2(g) ![]() 2H2O(g) ΔH2 =-571.6 kJmol-1
2H2O(g) ΔH2 =-571.6 kJmol-1
2CO(g) +O2(g)![]() 2CO2(g) ΔH3 =-566.0 kJmol-1
2CO2(g) ΔH3 =-566.0 kJmol-1
则煤气化主要反应的热化学方程式是:C(s)+ H2O(g)![]() CO(g) + H2(g) ΔH =________kJmol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
CO(g) + H2(g) ΔH =________kJmol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
(3) 已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g) ![]() 2NH3 (g) ΔH =_________
2NH3 (g) ΔH =_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com