
【题目】美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )
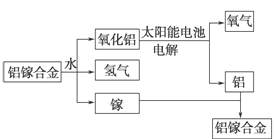
A. 该过程中,能量的转化形式只有两种
B. 铝镓合金可以循环使用
C. 铝镓合金与水反应的化学方程式为:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
D. 总反应式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】砷![]() 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成![]() 、
、![]() 、
、![]() 、
、![]() 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途![]() 回答下列问题:
回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣![]() 主要成分为
主要成分为![]() 制成浆状,通入
制成浆状,通入![]() 氧化,生成
氧化,生成![]() 和单质硫
和单质硫![]() 写出发生反应的化学方程式 _____________________________________________
写出发生反应的化学方程式 _____________________________________________ ![]() 该反应需要在加压下进行,原因是 _______________________________________
该反应需要在加压下进行,原因是 _______________________________________
(3)已知:![]()
![]()
![]()
则反应![]() 的
的![]() ________________________
________________________
(4)![]() 时,将
时,将![]() 、
、![]()
![]() 和20mLNaOH溶液混合,发生反应:
和20mLNaOH溶液混合,发生反应:![]() 溶液中
溶液中![]() 与反应时间
与反应时间![]() 的关系如图所示.
的关系如图所示.

①下列可判断反应达到平衡的是 ______ ![]() 填标号
填标号![]() .
.
![]() 溶液的pH不再变化
溶液的pH不再变化 ![]()
![]()
![]() 不再变化
不再变化 ![]()
![]()
②![]() 时,
时,![]() ______
______![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]()
③![]() 时,
时,![]() ______
______![]() 时
时![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() ,理由是 ____________________
,理由是 ____________________
④若平衡时溶液的![]() ,则该反应的平衡常数K为 ______________
,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素的族序数之和是A元素族序数的2倍,B和C原子序数之和是A的四倍;则A、B、C分别为( )

A. Be、Na、AlB. B、Mg、Si
C. C、Al、PD. O、P、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于核外电子排布的说法中不正确的是( )
A. 第n电子层最多可容纳的电子数为2n2
B. 次外层中最多可容纳的电子数为18
C. 最多可容纳2个电子的电子层一定是第一电子层
D. 最多可容纳8个电子的电子层一定是第二电子层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) (单位皆为molL-1min-1)表示,则下列式子中,正确的是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) (单位皆为molL-1min-1)表示,则下列式子中,正确的是( )
A. 4v(NH3)=5 v(O2)B. 5 v(O2)=6 v(H2O)
C. 2v(NH3)=3 v(H2O)D. 4v(O2)=5 v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是( )
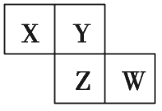
A. X、Y、Z的原子半径大小:X>Y>Z
B. Y、Z的气态氢化物中,前者更稳定
C. Z、W的最高价氧化物对应水化物的酸性,前者更强
D. X、W的气态氢化物相互反应,生成物中只含离子键不含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中以粗铜粉(含杂质Fe)为原料,制备铜的氯化物的流程如下:

请按要求回答下列问题:
(1)现用如图所示的实验仪器和药品来制备纯净、干燥的Cl2并与粗铜粉反应(铁架台和加热装置等省略)。

①按气流方向连接各仪器接口,正确的顺序是a→________→________→________→________→________→________→________。_______实验中硬质玻璃管加热前要进行一步重要操作,该操作是________________________________________________________。
②操作②的方法是________________________________。
(2)上述流程中,所得固体Ⅰ需要加稀盐酸溶解,其目的是________________________;
溶液Ⅰ可加试剂X用于调节pH以除去杂质,X最好选用下列试剂中的________(填字母)。
a.Cu b.NH3·H2O
c.CuO d.Cu2(OH)2CO3
e.H2S
(3)向溶液Ⅱ中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀,写出该反应的离子方程式:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com