
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①在一定条件下,在一个容积固定为2L的密闭容器中充入0.8molNO和1.20molCO,开始反应至3min时测得CO的转化率为20%,则用N2表示的平均反应速率为V(N2)=__________。
②对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=______________。
③该反应在低温下能自发进行,该反应的△H_______0,(选填“>”、“=”或“<”)
④在某一绝热,恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知t2—t1=t3—t2)。则下列说法不正确的是__________。(填编号)
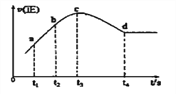
A.反应在c点未达到平衡状态 B.反应速率a点小于b点
C.反应物浓度a点大于b点 D.NO的转化率t1—t2=t2—t3
(2)使用甲醇汽油可能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)CH3OH(g),到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通人3molCO,此时v(正)____v(逆)(选填‘‘>”、“<’’或“=”),判断的理由____________。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比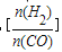 的变化曲线如图:
的变化曲线如图:
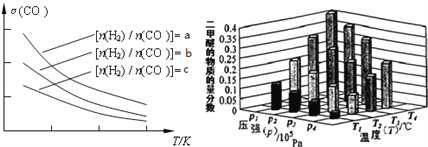
①a、b、c按从大到小的顺序排序为___________。
②某温度下,将2.0mol CO(g)和4.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如上图所示,关于温度和压强的关系判断正确的是___________;
A.P3>P2,T3>T2 B.P1>P3,T1>T3
C.P2>P4,T4>T2 D.P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___________:
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积百分含量增大
E.混合气体的密度减小
F.氢气的转化率减小
【答案】0. 02mol·(L·min)-1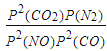 <D=QC=k,平衡不移动a>b>cB DB
<D=QC=k,平衡不移动a>b>cB DB
【解析】(1)①消耗CO物质的量为1.2mol×20%=0.24mol,v(CO)=![]() =0.04mol/(L·min),速率之比等于化学计量数之比,则v(N2)=
=0.04mol/(L·min),速率之比等于化学计量数之比,则v(N2)=![]() v(CO)=0.03mol/(L·min);
v(CO)=0.03mol/(L·min);
②由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比,2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)用某组分(B)的平衡压强(PB)表示平衡常数KP=
2CO2(g)+N2(g)用某组分(B)的平衡压强(PB)表示平衡常数KP=![]() ;
;
③正反应为气体物质的量减小的反应,为熵减反应,△S<0,而△H-T△S<0反应自发进行,该反应在低温下能自发进行,该反应的△H<0;
④从t4时刻正反应速率不变,处于平衡状态,t4时刻前未到达平衡,反应向正反应进行,由③中可知为反应热反应,绝热条件下,随反应进行温度升高,温度起主导作用,反应速率加快,而后浓度为主导因素,反应速率减低至平衡状态;A.反应在c点未达到平衡状态,故A正确;B.由图可知,反应速率a点小于b点,故B正确;C.反应物浓度a点大于b点,故C正确;D.NO的转化率:t1~t2<t2~t3,故D错误,故选D;
(2)温度不变,平衡常数不变,平衡常数K=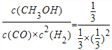 =9,通入3mol CO瞬间体积变为3L×
=9,通入3mol CO瞬间体积变为3L×![]() =6L,浓度商Qc=
=6L,浓度商Qc=![]() =9=K,平衡不移动,故v(正)=v(逆);
=9=K,平衡不移动,故v(正)=v(逆);
(3)①增大H2的浓度,平衡右移,CO的转化率增大,故有a>b>c;
②通过图2可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应方向为放热反应,则温度越高二甲醚的质量分数越小,故温度:T1>T2>T3>T4;正反应为气体体积减小的反应,增大压强平衡正向移动,二甲醚的质量分数增大,故压强P1>P2>P3>P4,故选BD;
③A.增大反应物浓度,平衡正向移动,正反应速率先增大后减小,不一定逆向移动,故A错误;B.逆反应速率先增大后减小,说明平衡逆向移动,故B正确;C.化学平衡常数K值增大,说明平衡正向移动,故C错误;D.如加入反应物,反应物的体积百分含量增大,但平衡正向移动,故D错误;E.移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小,故E错误;F.增大氢气的物质的量,平衡正向移动,但氢气转化率减小,故F错误,故选B。


科目:高中化学 来源: 题型:
【题目】工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g)ΔH = +Q kJ·mol-1 (Q >0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
Si(s)+4HCl(g)ΔH = +Q kJ·mol-1 (Q >0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为Q kJ
C. 将反应的温度由T1升高至T2,则对应温度下的平衡常数K1>K2
D. 当反应吸收热量为0.25Q kJ时,生成的HCl恰好与1 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为0.1 mol·L-1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度。
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤 (填“可行”或“不可行”)。
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 mol·L-1,滴定前将白醋稀释 (填“10”或“100”)倍。(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 。
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点。重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol·L-1)。
(6)原白醋中醋酸的物质的量浓度= mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com