
����Ŀ��(1)���ڷ�Ӧ2CO��O2=2CO2���ڱ�״���£�4.48 Lһ����̼������������������Ӧ�����ɵĶ�����̼���Ӹ�����__________________��
(2)����һ��Ȫˮ��Ʒ��1.0 L����Ȫˮ����4.8��10-2 g Mg2+����ô����Ȫˮ��Mg2+�����ʵ���Ũ����_______________����1.0 mol Mg2+������Ȫˮ�������_______________����
(3)���mg������a��ԭ�ӹ��ɣ���2mg�����к��еķ�����Ϊ_____________(�ú�a�Ĵ���ʽ��ʾ)��
(4)0.2mol�ĵ���Ax��1.2molB2��ȫ��Ӧ������0.8mol��AB3������Ax�Ļ�ѧʽ��_____________��
(5)����δ֪Ũ�ȵ�����25mL���ܸ�20mLijŨ�ȵ�����������Һ��ȫ��Ӧ��������0.1g̼�����25mL���������ã�ʣ�����������������������Һ4mL�����к͡������������ʵ���Ũ��Ϊ______________������������Һ�����ʵ���Ũ��Ϊ_________________��
���𰸡�0.2NA2��10-3mol��L-15000.25aA40.1mol��L-10.125mol��L-1
��������
��1���ڱ�״���£�4.48 Lһ����̼�����ʵ�����0.2mol�����ݷ���ʽ2CO��O2=2CO2��֪������������������Ӧ�����ɵĶ�����̼��0.2mol�����Ӹ�����0.2NA��
��2��1.0 LȪˮ����4.8��10-2 g Mg2+����Ȫˮ��Mg2+�����ʵ�����![]() �����������ʵ���Ũ����2��10-3mol��L-1����1.0 mol Mg2+������Ȫˮ�������
�����������ʵ���Ũ����2��10-3mol��L-1����1.0 mol Mg2+������Ȫˮ�������![]() ��
��
��3�����mg������a��ԭ�ӹ��ɣ�����![]() �����
�����![]() ������2mg�����к��еķ�����Ϊ
������2mg�����к��еķ�����Ϊ![]() ��
��
��4��0.2mol�ĵ���Ax��1.2molB2��ȫ��Ӧ������0.8mol��AB3�������Aԭ���غ��֪0.2��x��0.8�����x��4������Ax�Ļ�ѧʽ��A4��
��5����4mLNaOH��Һ���к�δ֪Ũ�ȵ�������Һ�����ΪX����20mL��25mL=4mL��X�����X=5mL�������0.1gCaCO3��Ӧ��������Һ�����Ϊ25mL-5mL=20mL����20mL�����к�HCl�����ʵ���ΪY����
CaCO3+2HCl=CaCl2+H2O+CO2��
100g 2mol
0.1g Y
���Y=0.002mol
���������Һ�����ʵ����ʵ���Ũ��Ϊ0.002mol��0.02L=0.1mol/L
��20mLijŨ�ȵ�NaOH��Һ�к��������Ƶ����ʵ���ΪZ������ݷ���ʽHCl+NaOH=NaCl+H2O��֪Z��0.025L��0.1mol/L��0.0025mol�����NaOH����Һ�����ʵ����ʵ���Ũ��Ϊ0.0025mol��0.02L��0.125mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��QΪԭ���������������ǰ������Ԫ�أ�X����δ�ɶԵ�������2����������Ԫ�ؾ����γɶ�Ԫ�����Y�ǵؿ��к������Ľ���Ԫ�أ�Z���Ŵ����ʵ����Ԫ��֮һ��W�ڲ��������������������9����Q��̬ԭ�Ӽ۲�����Ų��гɶԵ�������δ�ɶԵ�������ͬ���ݴ˻ش��������⣺
��1��Q�Ļ�̬ԭ�ӵļ۲�����Ų�ʽΪ____________________��
��2���縺��������_________________����һ�����ܽ���Y��Z֮���ͬ����Ԫ����__________ (��Ԫ�ط��ţ���
��3��Y��W���Ȼ����۵�ߵ���_________(�ѧʽ)��ԭ����____________________________����Z�ĵͼ��Ȼ��ﻥΪ�ȵ������������_____________��
��4������������������˷����ã���ṹ��ʽ��ͼ�������£���������ˮ�е��ܽ��Ϊ2g��������ˮ��������C6H4��OH����COONa���ݿ�ʹ���ܽ��������ԭ�������_____________________�������е�ԭ�ӵ��ӻ�������_______________��
��5����֪WX���ܶ�Ϊ3.25g/cm3����Ԫ�����߳�481pm����
ȷ���õ�Ԫ�����к���______��WX������__________�����ṹ(��д���ġ�������)�������о���W�����X��________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
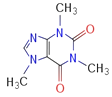
����Ŀ�����㻯����A��һ�ֻ�������ԭ�ϣ����Դ�ú��ʯ���еõ���A��B��C��D��E��ת����ϵ������ʾ��
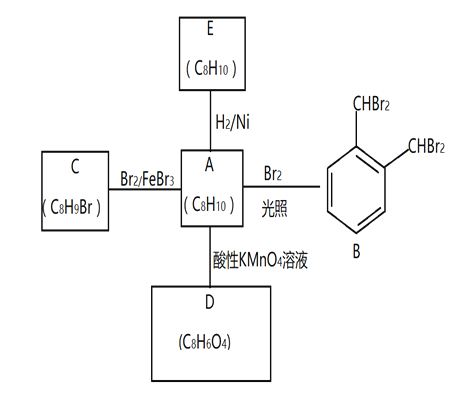
�ش��������⣺
��1��A�Ļ�ѧ������___________
��2��A��B �ķ�Ӧ������______________���ڸ÷�Ӧ�ĸ������У���B��Ϊͬ���칹��ĸ�����Ľṹ��ʽΪ______________________
��3��C�й���������_____________��A������KMnO4��Һ��Ӧ�ɵõ�D��д��D�й���������_______________________________
��4��A��E�Ļ�ѧ����ʽΪ____________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����Ƴ�����ĤH2Sȼ�ϵ�أ�ʵ��������H2S������Դ�����������õ�����������ĤH2Sȼ�ϵ�صĽṹʾ��ͼ����ͼ��ʾ������˵������ȷ����

A. �缫aΪ��صĸ���
B. �缫b�Ϸ����ĵ缫��ӦΪ��O2 +4H+ + 4e��=== 2H2O
C. ��·��ÿ����4 mol���ӣ�����������44.8 LH2S
D. ÿ17 g H2S���뷴Ӧ����1 mol H+������Ĥ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�Ħ�����������ǣ� ��
A.10mL H2O
B.0.8mol NaOH
C.54 g Al
D.1 g H3PO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼���ó�Ϊ����һ���µ��������������̼�IJ�����������Դ�����һ����Ҫ�о�������������ѧ֪ʶ�ش�
��1������CO2���������ȡ��ϩ��CO2��g��+3H2��g��![]() 1/2C2H4��g��+ 2H2O��g������ �÷�Ӧ��ϵ�������淴Ӧ���̱仯��ϵ����ͼ��ʾ�� ��÷�Ӧ����H =______���ú�a��b��ʽ�ӱ�ʾ����
1/2C2H4��g��+ 2H2O��g������ �÷�Ӧ��ϵ�������淴Ӧ���̱仯��ϵ����ͼ��ʾ�� ��÷�Ӧ����H =______���ú�a��b��ʽ�ӱ�ʾ����

��֪�����ֻ�ѧ���ļ������±���ʾ��ʵ����������Ӧ����H=-152kJmol��1������е�x=___________��
��ѧ�� | C=O | H-H | C=C | C-H | H-O |
����/kJmol��1 | 803 | 436 | x | 414 | 464 |
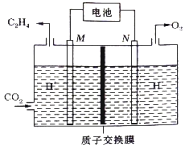
�� ��ϡ����Ϊ�������Һ������̫���ܵ�ؽ�CO2ת��Ϊ��ϩ�Ĺ���ԭ������ͼ��ʾ����N���ϵĵ缫��ӦʽΪ____________���õ��������������ܷ�Ӧ�Ļ�ѧ����ʽΪ__________��
��2����CO2�����������ȡ���ѵķ�Ӧ���£�2CO2��g��+6H2��g��![]() CH3OCH3��g��+ 3H2O��g�� ��H=��122.5 kJmol��1��ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת��������ͼ��ʾ��
CH3OCH3��g��+ 3H2O��g�� ��H=��122.5 kJmol��1��ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת��������ͼ��ʾ��

��T1_______T2������<������=����>�������������__________________________��
��T1�¶��£���6 mol CO2��12mol H2����2 L���ܱ������У�����5 min��Ӧ�ﵽƽ�⣬��0�� 5 min�ڵ�ƽ����Ӧ�����ԣ�CH3OCH3��=______��
��һ�������£������ϳɶ����ѵķ�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ij�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ�����______�����ţ���
A���淴Ӧ������������С B�������� c��H2��/c��CO2���ı�ֵ��С
C��H2��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CuO�����ܱյ����������,��Ӧ4CuO(s)![]() 2Cu2O(s)+O2(g)�ﵽƽ�⡣�����¶Ȳ���,�������ݻ���С��ԭ����һ��,��ϵ���´ﵽƽ��,����˵����ȷ���ǡ�(����)
2Cu2O(s)+O2(g)�ﵽƽ�⡣�����¶Ȳ���,�������ݻ���С��ԭ����һ��,��ϵ���´ﵽƽ��,����˵����ȷ���ǡ�(����)
A. c(O2)����ԭƽ���һ����С��ԭƽ��Ķ���
B. ������ɫ����
C. ����ѹǿ����
D. �÷�Ӧ�ڸ����²����Է����У���Ӧ�ġ�H< 0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ������ˮ�ⷴӦ������Һ�����Ե��� ( )
A. HCO3- + H2O ![]() H3O+ + CO32- B. Fe3+ + 3H2O
H3O+ + CO32- B. Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. HS- + H2O ![]() H2S + OH- D. NH4+ + OH-
H2S + OH- D. NH4+ + OH- ![]() NH3��+ H2O
NH3��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����. �ס��ҡ��������ֲ�����ͬ���ӵĿ�����ǿ����ʣ�������������������ʾ��
������ | NH4+��Mg2+��Ba2+ |
������ | OH����NO3����Cl�� |
ȡ�����������ֻ�����������ͬ�������Һ�������ʵ����ʵ���Ũ�ȣ�c(��)>c(��)>c(��)��
��1������_________________
��2��������__________________�����ʵ��ȷ�����������_______________________���������������ȷ������˿ղ��
��. ��ͼΪʵ����ijŨ�����Լ�ƿ�ı�ǩ���Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
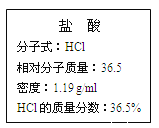
��1����Ũ������HCl�����ʵ���Ũ��Ϊ__________��
��2��ijѧ����������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.40 mol/L��ϡ���ᡣ
�ٸ�ѧ������Ͳ��ȡ________mL����Ũ����������ơ�
�������ƹ����У�����ʵ��������������������ʵ���Ũ���к�Ӱ�죿���ڿո����� ��ƫ�ߡ�����ƫ�͡�����Ӱ�족����
����ʱ���ӹ۲�_________��
���ݺ���ҡ�ȡ����ú���Һ���½����ټ�����������ˮ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com