
【题目】低碳经济成为人们一种新的生活理念。二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合所学知识回答:
(1)①用CO2催化加氢可制取乙烯:CO2(g)+3H2(g)![]() 1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。
1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。

已知:几种化学键的键能如下表所示,实验测得上述反应的△H=-152kJmol﹣1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | H-O |
键能/kJmol﹣1 | 803 | 436 | x | 414 | 464 |
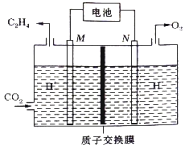
② 以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如下图所示。则N极上的电极反应式为____________;该电解池中所发生的总反应的化学方程式为__________。
(2)用CO2催化加氢可以制取乙醚的反应如下:2CO2(g)+6H2(g)![]() CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。
CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。

①T1_______T2(填“<”、“=”或“>”),判断理由是__________________________。
②T1温度下,将6 mol CO2和12mol H2充入2 L的密闭容器中,经过5 min反应达到平衡,则0~ 5 min内的平均反应速率υ(CH3OCH3)=______。
③一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是______(填标号)。
A.逆反应速率先增大后减小 B.容器中 c(H2)/c(CO2)的比值减小
C.H2的转化率增大
【答案】 -(b-a)kJmol﹣1 764 kJmol﹣1 2H2O-4e-═4H++O2↑ 2CO2+2H2O![]() C2H4+3O2↑ < 因为反应放热,相同配比投料时, T1温度下转化率大于T2温度下的转化率,平衡逆向移动,可知T1<T2 0.18 molL﹣1min﹣1 C
C2H4+3O2↑ < 因为反应放热,相同配比投料时, T1温度下转化率大于T2温度下的转化率,平衡逆向移动,可知T1<T2 0.18 molL﹣1min﹣1 C
【解析】试题分析:本题考查反应热的计算,电解原理的应用和电极反应式、电解方程式的书写,化学平衡图像的分析,化学反应速率的计算以及外界条件对化学平衡的影响。
(1)①由图知CO2(g)+3molH2(g)具有的总能量大于1/2C2H4(g)+2H2O(g)具有的总能量,该反应为放热反应,反应的ΔH=生成物具有的总能量-反应物具有的总能量=-(b-a)kJ/mol。ΔH=反应物的键能总和-生成物的键能总和=2E(C=O)+3E(H-H)-[1/2E(C=C)+2E(C-H)+4E(H-O)]=2![]() 803kJ/mol+3
803kJ/mol+3![]() 436kJ/mol-[1/2x+2
436kJ/mol-[1/2x+2![]() 414kJ/mol+4
414kJ/mol+4![]() 464kJ/mol]=-152kJ/mol,解得x=764kJ/mol。
464kJ/mol]=-152kJ/mol,解得x=764kJ/mol。
②根据图示,在M电极上CO2发生得电子的还原反应生成C2H4,M电极为阴极,M极上的电极反应式为2CO2+12e-+12H+=C2H4+4H2O;N电极为阳极,N电极上生成O2, N极上的电极反应式为2H2O-4e-=O2↑+4H+。则电解池中所发生的总反应的化学方程式为2CO2+2H2O![]() C2H4+3O2。
C2H4+3O2。
(2)①该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,CO2的转化率减小,根据图像知在投料比相同时,T1平衡时CO2的转化率大于T2,则T1![]() T2。
T2。
②H2与CO2的投料比为12mol![]() 6mol=2,根据图像投料比为2时,T1温度下CO2的平衡转化率为60%。转化CO2物质的量浓度为
6mol=2,根据图像投料比为2时,T1温度下CO2的平衡转化率为60%。转化CO2物质的量浓度为![]() 60%=1.8mol/L,则转化CH3OCH3(g)物质的量浓度为0.9mol/L,0~5min内平均反应速率υ(CH3OCH3)=0.9mol/L
60%=1.8mol/L,则转化CH3OCH3(g)物质的量浓度为0.9mol/L,0~5min内平均反应速率υ(CH3OCH3)=0.9mol/L![]() 5min=0.18mol/(L·min)。
5min=0.18mol/(L·min)。
③A,逆反应速率先增大后减小,平衡一定向逆反应方向移动;B,容器中c(H2)/c(CO2)的比值减小,可能增大CO2浓度、减小H2浓度,增大CO2浓度平衡向正反应方向移动,减小H2浓度平衡向逆反应方向移动;C,H2的转化率增大,平衡一定向正反应方向移动;改变某个条件,平衡一定向正反应方向移动的是C,答案选C。


科目:高中化学 来源: 题型:
【题目】下列各组物质分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | 硫酸 | 纯碱 | 硫酸钙 | 氧化铁 |
B | 盐酸 | 烧碱 | 纯碱 | 氧化钙 |
C | 碳酸 | 硫酸钙 | 碳酸钠 | 干冰 |
D | 干冰 | 苛性钠 | 食盐 | 石灰石 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖和淀粉的混合物中氢的质量分数为6.5%,则混合物中氧的质量分数为 ( )
A. 13.0% B. 39.0% C. 45.5% D. 52.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )

A. 该硫酸的浓度为9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需该H2SO4125mL
C. 该硫酸与等体积水混合质量分数变为49%
D. 取该硫酸100 mL,则浓度变为原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应2CO+O2=2CO2,在标准状况下,4.48 L一氧化碳与足量的氧气发生反应,生成的二氧化碳分子个数是__________________。
(2)现有一种泉水样品,1.0 L这种泉水含有4.8×10-2 g Mg2+。那么,该泉水中Mg2+的物质的量浓度是_______________,含1.0 mol Mg2+的这种泉水的体积是_______________升。
(3)如果mg氨气由a个原子构成,则2mg硫化氢中含有的分子数为_____________(用含a的代数式表示)。
(4)0.2mol的单质Ax和1.2molB2完全反应,生成0.8mol的AB3,则单质Ax的化学式是_____________。
(5)现有未知浓度的盐酸25mL,能跟20mL某浓度的氢氧化钠溶液完全反应。若先用0.1g碳酸钙与25mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4mL才能中和。则该盐酸的物质的量浓度为______________,氢氧化钠溶液的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明CH4分子空间结构为正四面体而非平面正方形的事实是
A.CH4分子中的四个碳氢键的键能相等B.CH3Cl分子只有一种结构
C.CHCl3分子只有一种结构D.CH2Cl2分子只有一种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表的第IIA族
B.H2O比H2S稳定是因为H2O分子间有氢键
C.离子化合物中可能含有共价键
D.因为盐酸的酸性比氢硫酸(H2S水溶液)强,所以非金属性:Cl﹥S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废气物进行脱硫(SO2)处理并加以利用,不仅可防止大气污染,还能实现一定经济效益。回答下列问题:
(1)热化学碘硫循环脱硫,涉及以下三个反应:
bunsen反应:SO2(g)+I2(g)+2H2O(l)═2HI (g)+H2SO4(l) △H
硫酸分解反应:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=+462kJ·mol-1
碘化氢分解反应:2HI(g)=H2(g)+I2(g)△H=+10kJ·mol-1
已知氢气的燃烧热为286kJ·mol-1,则bunsen反应的△H=_________kJ·mol-1。
(2)在活性炭催化下,SO2与Cl2发生反应:SO2(g)+Cl2(g)![]() SO2Cl2(g)△H<0。在定温定压条件下,容器体积为10L的容器中加入等物质的量的SO2和Cl2,充分混合(二者物质的量均为nmol)后,达到平衡后容器体积为8L。
SO2Cl2(g)△H<0。在定温定压条件下,容器体积为10L的容器中加入等物质的量的SO2和Cl2,充分混合(二者物质的量均为nmol)后,达到平衡后容器体积为8L。
①SO2Cl2能与水发生非氧化还原反应,生成两种酸,则这两种酸的化学式为_________。
②下列事实中,不能作为判断硫元素和氯元素非金属性强弱的依据是_________(填字母)。
A.硫化氢的分解温度为300℃左右,氯化氢1500℃才分解
B.氢硫酸(H2S的水溶液)是一种弱酸,盐酸是强酸
C.将氯气通入氢硫酸中,溶液中产生黄色浑浊
D.高氯酸在无机含氧酸中酸性最强
③该温度下,SO2的平衡转化率α1=_________,反应的平衡常数K=_________(列式并计算)。
④下列措施中不能进一步提高氯气的平衡转化率的是_________。
A.平衡后将容器的体积压缩为4L B.增大二氧化硫的浓度
C.升高温度 D.将SO2Cl2(g)液化分离
⑤若向该容器中初始投入SO2和Cl2的物质的量均为0.5nmol,则达到平衡时SO2的平衡转化率:α2_________填“>”“<”或“=”)α1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的酸性溶液中能大量共存的是( )
A.Na+、K+、Cu2+、SO42-B.NH4+、Na+、NO3-、Cl-
C.K+、Ca2+、HCO3-、Cl-D.Mg2+、Fe3+、Cl-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com