
【题目】葡萄糖和淀粉的混合物中氢的质量分数为6.5%,则混合物中氧的质量分数为 ( )
A. 13.0% B. 39.0% C. 45.5% D. 52.0%
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是

A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e=2Cl+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,下列有关电解质溶液的描述正确的是 ( )
A. 向Na2CO3溶液中通入CO2至溶液为中性,则![]()
B. pH相同的氨水和Ba(OH)2溶液中:2c(NH4+)= c( Ba2+)
C. 等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH-)-c(H+)=c(HSO3-)+c(H2SO3)
D. 向Mg(OH)2浊液中加入少量NH4Cl粉末![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成多种含氧酸。
(1)次磷酸(H3PO2)是一种精细化工产品,向10 mL H3PO2溶液中加入10 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子。
① 写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式:_______,该正盐溶液中各离子浓度由大到小的顺序为____________。
② 若25℃时,K (H3PO2) = 1×10-2,则0.01 mol · L-1的H3PO2溶液的pH =________。
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1= 1×10-2、K2=2.6×10-7。
① 试从电离平衡移动的角度解释K1、K2数据的差异_______________。
② NaH2PO3溶液显______性(填“酸”“碱”或“中”)。
(3) 25 ℃时,HF的电离常数为K = 3.6×10-4; H3PO4的电离常数为K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为_________。
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中。c(H+)由大到小的顺序为_____(用酸的分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如下所示:
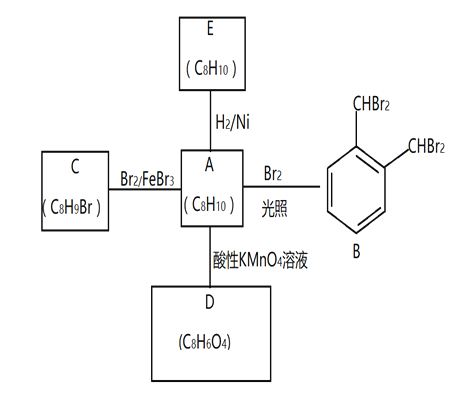
回答下列问题:
(1)A的化学名称是___________
(2)A→B 的反应类型是______________。在该反应的副产物中,与B互为同分异构体的副产物的结构简式为______________________
(3)C中官能团名称_____________;A与酸性KMnO4溶液反应可得到D,写出D中官能团名称_______________________________
(4)A→E的化学方程式为____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置及实验方案的设计不正确的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
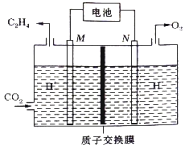
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下图所示。下列说法不正确的是

A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2 +4H+ + 4e﹣=== 2H2O
C. 电路中每流过4 mol电子,在正极消耗44.8 LH2S
D. 每17 g H2S参与反应,有1 mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济成为人们一种新的生活理念。二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合所学知识回答:
(1)①用CO2催化加氢可制取乙烯:CO2(g)+3H2(g)![]() 1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。
1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。

已知:几种化学键的键能如下表所示,实验测得上述反应的△H=-152kJmol﹣1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | H-O |
键能/kJmol﹣1 | 803 | 436 | x | 414 | 464 |
② 以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如下图所示。则N极上的电极反应式为____________;该电解池中所发生的总反应的化学方程式为__________。
(2)用CO2催化加氢可以制取乙醚的反应如下:2CO2(g)+6H2(g)![]() CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。
CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。

①T1_______T2(填“<”、“=”或“>”),判断理由是__________________________。
②T1温度下,将6 mol CO2和12mol H2充入2 L的密闭容器中,经过5 min反应达到平衡,则0~ 5 min内的平均反应速率υ(CH3OCH3)=______。
③一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是______(填标号)。
A.逆反应速率先增大后减小 B.容器中 c(H2)/c(CO2)的比值减小
C.H2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位.请回答下列问题:
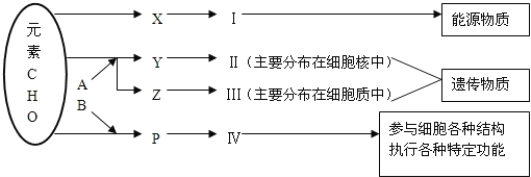
(1)图中X是________,Ⅰ在植物细胞中主要是指___________。
(2)与Ⅳ相比,Ⅱ特有的元素是_____。
(3)鉴定Ⅳ使用_______试剂,反应呈现______色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com