
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A. HCO3- + H2O ![]() H3O+ + CO32- B. Fe3+ + 3H2O
H3O+ + CO32- B. Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. HS- + H2O ![]() H2S + OH- D. NH4+ + OH-
H2S + OH- D. NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
科目:高中化学 来源: 题型:
【题目】某兴趣小组拟制备氯气并验证其一系列性质,实验装置如图所示(省略夹持装置)。已知:硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂
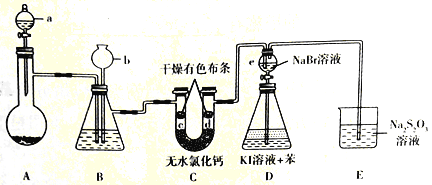
回答下列问题:
(1)仪器a的名称是______,其中盛有浓盐酸,烧瓶A 中盛有的固体试剂是_____(填化学式)。
(2)装置B中盛有饱和NaCl溶液,装置B的作用是________。
a.除去C12中的杂质HCl b.干燥
c.提供后续水蒸气 d.观察装置是否堵塞
(3)c处有色布条褪色,而d处不褪色,这说明__________。
(4)实验结束后,打开e 的活塞,使其中的溶液流人到锥形瓶D中,摇匀锥形瓶,静置后可观察到______________________。
(5)装置E中发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应2CO+O2=2CO2,在标准状况下,4.48 L一氧化碳与足量的氧气发生反应,生成的二氧化碳分子个数是__________________。
(2)现有一种泉水样品,1.0 L这种泉水含有4.8×10-2 g Mg2+。那么,该泉水中Mg2+的物质的量浓度是_______________,含1.0 mol Mg2+的这种泉水的体积是_______________升。
(3)如果mg氨气由a个原子构成,则2mg硫化氢中含有的分子数为_____________(用含a的代数式表示)。
(4)0.2mol的单质Ax和1.2molB2完全反应,生成0.8mol的AB3,则单质Ax的化学式是_____________。
(5)现有未知浓度的盐酸25mL,能跟20mL某浓度的氢氧化钠溶液完全反应。若先用0.1g碳酸钙与25mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4mL才能中和。则该盐酸的物质的量浓度为______________,氢氧化钠溶液的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表的第IIA族
B.H2O比H2S稳定是因为H2O分子间有氢键
C.离子化合物中可能含有共价键
D.因为盐酸的酸性比氢硫酸(H2S水溶液)强,所以非金属性:Cl﹥S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe,Cu的混合物投入含有Fe2+,Cu2+,Fe3+的溶液中,反应后有铁剩余,则容器内还应存在的微粒是( )
A.Fe3+,Fe2+B.Fe2+,Cu2+C.Cu,Fe2+D.Cu,Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废气物进行脱硫(SO2)处理并加以利用,不仅可防止大气污染,还能实现一定经济效益。回答下列问题:
(1)热化学碘硫循环脱硫,涉及以下三个反应:
bunsen反应:SO2(g)+I2(g)+2H2O(l)═2HI (g)+H2SO4(l) △H
硫酸分解反应:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=+462kJ·mol-1
碘化氢分解反应:2HI(g)=H2(g)+I2(g)△H=+10kJ·mol-1
已知氢气的燃烧热为286kJ·mol-1,则bunsen反应的△H=_________kJ·mol-1。
(2)在活性炭催化下,SO2与Cl2发生反应:SO2(g)+Cl2(g)![]() SO2Cl2(g)△H<0。在定温定压条件下,容器体积为10L的容器中加入等物质的量的SO2和Cl2,充分混合(二者物质的量均为nmol)后,达到平衡后容器体积为8L。
SO2Cl2(g)△H<0。在定温定压条件下,容器体积为10L的容器中加入等物质的量的SO2和Cl2,充分混合(二者物质的量均为nmol)后,达到平衡后容器体积为8L。
①SO2Cl2能与水发生非氧化还原反应,生成两种酸,则这两种酸的化学式为_________。
②下列事实中,不能作为判断硫元素和氯元素非金属性强弱的依据是_________(填字母)。
A.硫化氢的分解温度为300℃左右,氯化氢1500℃才分解
B.氢硫酸(H2S的水溶液)是一种弱酸,盐酸是强酸
C.将氯气通入氢硫酸中,溶液中产生黄色浑浊
D.高氯酸在无机含氧酸中酸性最强
③该温度下,SO2的平衡转化率α1=_________,反应的平衡常数K=_________(列式并计算)。
④下列措施中不能进一步提高氯气的平衡转化率的是_________。
A.平衡后将容器的体积压缩为4L B.增大二氧化硫的浓度
C.升高温度 D.将SO2Cl2(g)液化分离
⑤若向该容器中初始投入SO2和Cl2的物质的量均为0.5nmol,则达到平衡时SO2的平衡转化率:α2_________填“>”“<”或“=”)α1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷元素是组成遗传物质核酸的基本成分之一,而锡元素(Sn)形成的某些化合物能够促进核酸的合成。回答下列问题。
(1)基态磷原子电子占据的最高能层符号是____,占据该能层的电子中能量最高的电子其电子云在空间有_____个伸展方向,原子轨道呈_____形。
(2)锡元素可形成白锡、灰锡、脆锡三种单质。研究灰锡晶体的结构最常用的仪器是_____。灰锡晶体与金刚石结构相同,但灰锡不稳定,其原因是_____。
(3)固态PCl5结构中存在PCl4+和PCl6-两种结构单元,其晶胞如图所示。

①PCl4+的空间结构为________,PCl3的键角小于PCl4+键角的原因为___________。
②已知晶胞的边长为anm,阿伏加德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为_______pm,固态PCl5的密度为______g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍具有较高的经济价值,工业上采用一定方法处理含镍废水使其达标排放并回收镍。某电镀废水中的镍主要以NiR2络合物形式存在,在水溶液中存在以下平衡:NiR2 (aq) ![]() Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
(1)传统的“硫化物沉淀法”是向废水中加入Na2S,使其中的NiR2生成NiS沉淀进而回收镍。
①该反应的离子方程式为_________。
②NiS沉淀生成的同时会有少量Ni(OH)2沉淀生成,用离子方程式解释Ni(OH)2生成的原因是_________、_________。
(2)“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。工艺流程如下:
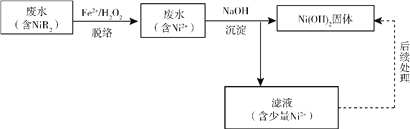
“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R—与中间产物·OH(羟基自由基)反应生成难以与Ni2+络合的·R(有机物自由基),但·OH也能与H2O2发生反应。反应的方程式如下:
Fe2+ + H2O2 ![]() Fe3+ + OH— +·OH …………i
Fe3+ + OH— +·OH …………i
R— + ·OH ![]() OH—+ ·R …………ii
OH—+ ·R …………ii
H2O2 +2·OH ![]() O2↑ + 2H2O …………iii
O2↑ + 2H2O …………iii
实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如右图所示:
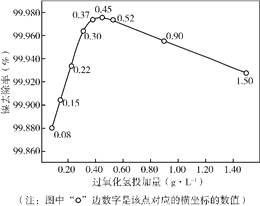
①从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是_________。
②分析图中曲线,可推断过氧化氢的最佳加入量为_________ g·L-1;低于或高于这个值,废水处理效果都下降,原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com