
����Ŀ�����������нϸߵľ��ü�ֵ����ҵ�ϲ���һ����������������ˮʹ�����ŷŲ���������ij��Ʒ�ˮ�е�����Ҫ��NiR2�������ʽ���ڣ���ˮ��Һ�д�������ƽ�⣺NiR2 (aq) ![]() Ni2+(aq) +2R-(aq) ��R-Ϊ�л������壬K=1.6��10-14��
Ni2+(aq) +2R-(aq) ��R-Ϊ�л������壬K=1.6��10-14��
��1����ͳ�ġ�����������������ˮ�м���Na2S��ʹ���е�NiR2����NiS����������������
�ٸ÷�Ӧ�����ӷ���ʽΪ_________��
��NiS�������ɵ�ͬʱ��������Ni(OH)2�������ɣ������ӷ���ʽ����Ni(OH)2���ɵ�ԭ����_________��_________��
��2������������������Ļ����ʲ��ߣ��������ˮ�е����������Դ�ꡣ��������-��ѧ���������ɴﵽԤ��Ч�����÷�����ת��ΪNi(OH)2��������������������������£�
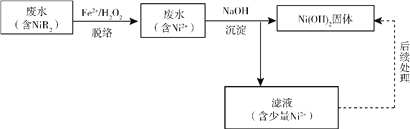
�����硱��ָ��Ԫ���������NiR2ת���������Ni2+�������У�R�����м���OH���ǻ����ɻ�����Ӧ����������Ni2+��ϵġ�R���л������ɻ���������OHҲ����H2O2������Ӧ����Ӧ�ķ���ʽ���£�
Fe2+ + H2O2 ![]() Fe3+ + OH�� +��OH ��������i
Fe3+ + OH�� +��OH ��������i
R�� + ��OH ![]() OH��+ ��R ��������ii
OH��+ ��R ��������ii
H2O2 +2��OH ![]() O2�� + 2H2O ��������iii
O2�� + 2H2O ��������iii
ʵ���á����硱������H2O2�ļ���������Һ����ȥ���ʵ�Ӱ������ͼ��ʾ��
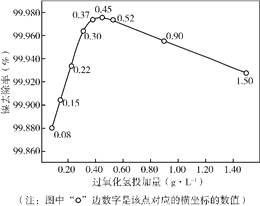
�ٴ�ƽ���ƶ��ĽǶȽ��ͼ���Fe2+��H2O2�ܹ�ʵ�֡����硱��ԭ����_________��
�ڷ���ͼ�����ߣ����ƶϹ����������Ѽ�����Ϊ_________ g��L-1�����ڻ�������ֵ����ˮ����Ч�����½���ԭ����_________��
���𰸡� NiR2 + S2- ![]() NiS��+ 2R- S2- + H2O
NiS��+ 2R- S2- + H2O ![]() HS- + OH- NiR2 + 2OH-
HS- + OH- NiR2 + 2OH- ![]() Ni(OH)2��+ 2R- NiR2����Һ�д�������ƽ�⣺NiR2 (aq)
Ni(OH)2��+ 2R- NiR2����Һ�д�������ƽ�⣺NiR2 (aq) ![]() Ni2+(aq) +2R-(aq)��Fe2+��H2O2ͨ����Ӧi�ͷ�Ӧii��R��ת����������Ni2+��ϵġ�R�� ʹc(R-)��С��ƽ�������ƶ���ʵ�֡����硱 0.45 ���ڴ���ֵ����Ӧi���ɵġ�OH���٣�������ʹR�����ת���ɡ�R�����ڴ���ֵ��H2O2�࣬����Ӧi���ɵġ�OH����H2O2������Ӧiii��ʹH2O2ת����O2��H2O��ͬ������ʹR�����ת���ɡ�R��
Ni2+(aq) +2R-(aq)��Fe2+��H2O2ͨ����Ӧi�ͷ�Ӧii��R��ת����������Ni2+��ϵġ�R�� ʹc(R-)��С��ƽ�������ƶ���ʵ�֡����硱 0.45 ���ڴ���ֵ����Ӧi���ɵġ�OH���٣�������ʹR�����ת���ɡ�R�����ڴ���ֵ��H2O2�࣬����Ӧi���ɵġ�OH����H2O2������Ӧiii��ʹH2O2ת����O2��H2O��ͬ������ʹR�����ת���ɡ�R��
��������(1)�����ˮ(����Ҫ��NiR2�������ʽ����)�м���Na2S��ʹ���е�NiR2����NiS��������Ӧ�����ӷ���ʽΪNiR2 + S2- = NiS��+ 2R-���ʴ�Ϊ��NiR2 + S2- = NiS��+ 2R-��
��NiS�������ɵ�ͬʱ��������Ni(OH)2�������ɣ�����ΪS2- + H2O ![]() HS- + OH-��NiR2 + 2OH- = Ni(OH)2��+ 2R-���ʴ�Ϊ��S2- + H2O
HS- + OH-��NiR2 + 2OH- = Ni(OH)2��+ 2R-���ʴ�Ϊ��S2- + H2O ![]() HS- + OH-��NiR2 + 2OH- = Ni(OH)2��+ 2R-��
HS- + OH-��NiR2 + 2OH- = Ni(OH)2��+ 2R-��
(2)��NiR2����Һ�д�������ƽ�⣺NiR2 (aq) ![]() Ni2+(aq) +2R-(aq)��Fe2+��H2O2ͨ����Ӧi�ͷ�Ӧii��R��ת����������Ni2+��ϵ���R�� ʹc(R-)��С��ƽ�������ƶ���ʵ�������������ʴ�Ϊ��NiR2����Һ�д�������ƽ�⣺NiR2 (aq)
Ni2+(aq) +2R-(aq)��Fe2+��H2O2ͨ����Ӧi�ͷ�Ӧii��R��ת����������Ni2+��ϵ���R�� ʹc(R-)��С��ƽ�������ƶ���ʵ�������������ʴ�Ϊ��NiR2����Һ�д�������ƽ�⣺NiR2 (aq) ![]() Ni2+(aq) +2R-(aq)��Fe2+��H2O2ͨ����Ӧi�ͷ�Ӧii��R��ת����������Ni2+��ϵ���R�� ʹc(R-)��С��ƽ�������ƶ���ʵ������������
Ni2+(aq) +2R-(aq)��Fe2+��H2O2ͨ����Ӧi�ͷ�Ӧii��R��ת����������Ni2+��ϵ���R�� ʹc(R-)��С��ƽ�������ƶ���ʵ������������
�ڸ���ͼ�����ߣ���������ļ�����Ϊ0.45g��L-1ʱ����Һ����ȥ������ߣ����ڻ�������ֵ����ˮ����Ч�����½���ԭ���ǵ��ڴ���ֵ����Ӧi���ɵ���OH���٣�������ʹR�����ת������R�����ڴ���ֵ��H2O2�࣬����Ӧi���ɵ���OH����H2O2������Ӧiii��ʹH2O2ת����O2��H2O��ͬ������ʹR�����ת������R���ʴ�Ϊ��0.45�����ڴ���ֵ����Ӧi���ɵ���OH���٣�������ʹR-���ת������R�����ڴ���ֵ��H2O2�࣬����Ӧi���ɵ���OH����H2O2������Ӧiii��ʹH2O2ת����O2��H2O��ͬ������ʹR-���ת������R��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����Ƴ�����ĤH2Sȼ�ϵ�أ�ʵ��������H2S������Դ�����������õ�����������ĤH2Sȼ�ϵ�صĽṹʾ��ͼ����ͼ��ʾ������˵������ȷ����

A. �缫aΪ��صĸ���
B. �缫b�Ϸ����ĵ缫��ӦΪ��O2 +4H+ + 4e��=== 2H2O
C. ��·��ÿ����4 mol���ӣ�����������44.8 LH2S
D. ÿ17 g H2S���뷴Ӧ����1 mol H+������Ĥ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ������ˮ�ⷴӦ������Һ�����Ե��� ( )
A. HCO3- + H2O ![]() H3O+ + CO32- B. Fe3+ + 3H2O
H3O+ + CO32- B. Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. HS- + H2O ![]() H2S + OH- D. NH4+ + OH-
H2S + OH- D. NH4+ + OH- ![]() NH3��+ H2O
NH3��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾϸ����ijЩ�л����Ԫ����ɺ��ܹ�ϵ������A��B����Ԫ�أ������������ӣ�ͼ��X��Y��Z��P�ֱ�Ϊ�����������ӵĻ�����λ����ش��������⣺
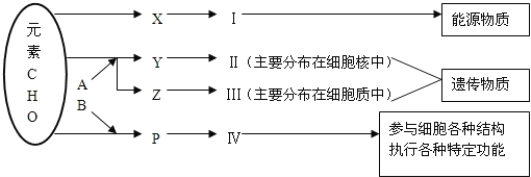
��1��ͼ��X��________������ֲ��ϸ������Ҫ��ָ___________��
��2�������ȣ������е�Ԫ����_____��
��3��������ʹ��_______�Լ�����Ӧ����______ɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������ܹ��Ի�ѧ��Ӧ�ٶ���������õ��ǣ� ��
A.�¶�
B.Ũ��
C.����
D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ն����з�Ӧ����û��Ӱ����� �� ��
A. ������������Ӧ B. ���������鷴Ӧ
C. ��ϩ��������Ȼ�̼��Һ��Ӧ D. ������ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����. �ס��ҡ��������ֲ�����ͬ���ӵĿ�����ǿ����ʣ�������������������ʾ��
������ | NH4+��Mg2+��Ba2+ |
������ | OH����NO3����Cl�� |
ȡ�����������ֻ�����������ͬ�������Һ�������ʵ����ʵ���Ũ�ȣ�c(��)>c(��)>c(��)��
��1������_________________
��2��������__________________�����ʵ��ȷ�����������_______________________���������������ȷ������˿ղ��
��. ��ͼΪʵ����ijŨ�����Լ�ƿ�ı�ǩ���Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
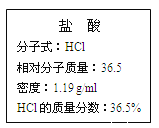
��1����Ũ������HCl�����ʵ���Ũ��Ϊ__________��
��2��ijѧ����������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.40 mol/L��ϡ���ᡣ
�ٸ�ѧ������Ͳ��ȡ________mL����Ũ����������ơ�
�������ƹ����У�����ʵ��������������������ʵ���Ũ���к�Ӱ�죿���ڿո����� ��ƫ�ߡ�����ƫ�͡�����Ӱ�족����
����ʱ���ӹ۲�_________��
���ݺ���ҡ�ȡ����ú���Һ���½����ټ�����������ˮ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ����
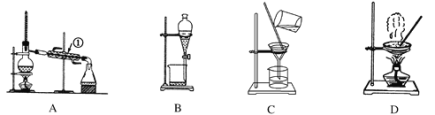
��������װ�ã���������ʵ�鷽���Ӻ��������������ȡ���п��������Ե���Ȼ�������֪�ױ��ͼ״���Ϊ�л��ܼ����л������ܻ��ܣ�

��1��װ��A�������ٵ�������________��ʹ��װ��A�IJ�����_____���a������b������c����d������ͬ����
��2��ʹ��װ��B�IJ�����______��Ϊʹ����Һ��˳�����£������¶˻����⣬��Ӧ���еľ��������___________________��
��3��ʹ��װ��C�IJ�����_______�������ó���������ˮ����Ҫϴ�ӣ���ϴ�ӵľ��������________________________________________________________________________________��
��4��ʹ��װ��D�IJ�����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�鼰����ó��Ľ�����ȷ����
ʵ�� | ���� | ���� | |
A | SO2��H2S������ | ��������ɫ���� | ������:SO2>S |
B | ��ʢ��FeSO4��Һ���Թ��е�����ˮ��Ȼ�����KSCN��Һ | ����KSCN����Һ��Ϊ��ɫ | ԭFeSO4��Һ�ѱ�������O2�������� |
C | �Թ���ʢ��Cu(NO3)2��Һ���ײ�������ͭ�������м���ϡ���� | ͭ�����ܽ� | ͭ����ϡ���ᷴӦ |
D | ��2֧ʢ��2mL��ͬŨ�ȵ�NaOH��Һ���Թ��зֱ����2����ͬŨ�ȵ�AlCl3��MgCl2��Һ�������� | ǰ�������������а�ɫ���� | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com