
【题目】《梦溪笔谈》有记:馆阁新书净本有误书处,以雌黄涂之。在中国古代,雌黄(As2S3)经常用来修改错字,其结构如图所示。下列说法不正确的是( )
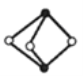
A.As、S原子的杂化方式均为sp3
B.AsH3的沸点比NH3的低
C.与As同周期且基态原子核外未成对电子数目相同的元素只有V
D.已知As2F2分子中各原子均满足8电子结构,分子中σ键和π键的个数比为3:1
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了解决能源的可再生及将CO2变废为宝等问题,科学家借鉴自然界的光合作用原理,通过“人工” 光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如下图所示。 请回答:
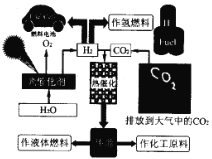
(1) 联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;______;在图示转化过程中,太阳能除了储存在甲醇中,还储存在_____中(填化学式)。
(2)图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。
已知:2H2(g)+O2(g)=2H2O (g)△H1= -483.6 kJmo1-1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1352.86 kJmol-1
△H =_____________。
(3)实验室对热催化反应进行模拟探究:一定温度下,向容积均为2 L 的恒容密闭容器中分别通入1.0 mol CO2(g)和3.0 mol H2(g), 在不同催化剂X、Y 的催化下发生反应。测得5 min时,CO2转化率与温度的变化关系如图所示。
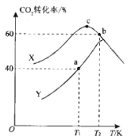
①该反应适宜选用的催化剂为__________(填“X'”或 “Y”)。
②T1K时,a点对应容器在0~5 min内的平均反应速率v(H2)=______;b、c点对应状态下反应物的有效碰撞几率b______c(填“>”“<”或“=”),原因为___________。
③T2K时,若反应前容器内的压强为p, 则该温度下反应的平衡常数KP=_________。 (KP为用分压表示的平衡常数)。
(4)我国化学家结合实验和计算机模拟结果,研究得出热催化反应的一种可能历程如图所示,其中自由基用“”标出,过渡态用TS表示。
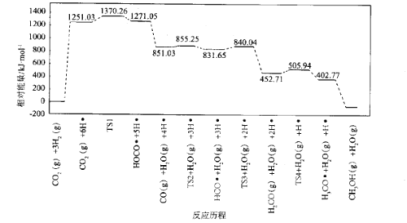
四个过渡态中对反应速率影响最大的是____,理由为____;该步骤的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A. C生成的速率是A反应速率的2倍
B. A、B、C的浓度不再变化
C. 单位时间内生成nmol A,同时生成3nmol B
D. A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸(C16H18O9)具有较广泛的抗菌、抗病毒、抗氧化作用,利用乙醚、60%乙醇浸泡杜仲干叶,得到提取液,进一步获得绿原酸粗产品的一种工艺流程如图,下列说法错误的是( )
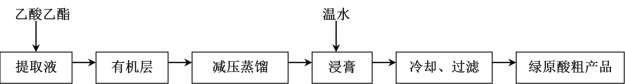
A.绿原酸在温水中的溶解度小于冷水中的溶解度
B.得到有机层的实验操作为萃取分液
C.减压蒸馏的目的防止温度过高,绿原酸变质
D.绿原酸粗产品可以通过重结晶进一步提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常采用“电催化氧化—化学沉淀法”对化学镀镍废水进行处理,电解过程中电解槽中H2O、Cl-放电产生·OH、HClO,在活性组分作用下,阴阳两极区发生的反应如下(R表示有机物):
①R+·OH→CO2+H2O
②R+HClO→CO2+H2O+Cl-
③H2PO![]() +2·OH-4e-=PO
+2·OH-4e-=PO![]() +4H+
+4H+
④HPO![]() +·OH-2e-=PO
+·OH-2e-=PO![]() +2H+
+2H+
⑤H2PO![]() +2ClO-=PO
+2ClO-=PO![]() +2H++2Cl-
+2H++2Cl-
⑥HPO![]() +ClO-=PO
+ClO-=PO![]() +H++Cl-
+H++Cl-
⑦Ni2++2e-=Ni
⑧2H++2e-=H2↑
下列说法不正确的是( )
A.·OH、HClO在阳极上产生
B.增大电极电压,电化学氧化速率加快
C.电解时,阴极附近pH逐渐升高,Ni2+去除率逐渐减小
D.向电解后的废水中加入CaCl2可以去除磷元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧![]() 可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
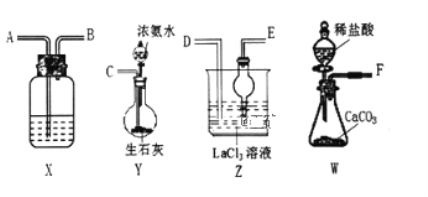
(1)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→_____→_____→_____→_____→_____;__________
(2)Y中发生反应的化学反应式为_______________;
(3)X中盛放的试剂是___________,其作用为___________________;
(4)Z中应先通入NH3,后通入过量的CO2,原因为__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)步骤②所用试剂X为___________(写化学式),D的官能团名称是_______;
(2)F的结构简式为________________,步骤①的反应类型:___________;
(3)写出下列步骤中的化学方程式(注明反应条件):
步骤③_____________________________________;
步骤④_______________________________________;
(4)用图2所示实验装置制取乙酸乙酯。请回答:试管b中所装溶液应为_____,乙酸乙酯生成后,分离出产品时的操作方法是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com