
【题目】为了解决能源的可再生及将CO2变废为宝等问题,科学家借鉴自然界的光合作用原理,通过“人工” 光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如下图所示。 请回答:
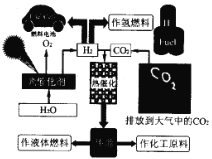
(1) 联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;______;在图示转化过程中,太阳能除了储存在甲醇中,还储存在_____中(填化学式)。
(2)图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。
已知:2H2(g)+O2(g)=2H2O (g)△H1= -483.6 kJmo1-1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1352.86 kJmol-1
△H =_____________。
(3)实验室对热催化反应进行模拟探究:一定温度下,向容积均为2 L 的恒容密闭容器中分别通入1.0 mol CO2(g)和3.0 mol H2(g), 在不同催化剂X、Y 的催化下发生反应。测得5 min时,CO2转化率与温度的变化关系如图所示。
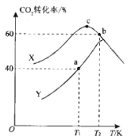
①该反应适宜选用的催化剂为__________(填“X'”或 “Y”)。
②T1K时,a点对应容器在0~5 min内的平均反应速率v(H2)=______;b、c点对应状态下反应物的有效碰撞几率b______c(填“>”“<”或“=”),原因为___________。
③T2K时,若反应前容器内的压强为p, 则该温度下反应的平衡常数KP=_________。 (KP为用分压表示的平衡常数)。
(4)我国化学家结合实验和计算机模拟结果,研究得出热催化反应的一种可能历程如图所示,其中自由基用“”标出,过渡态用TS表示。
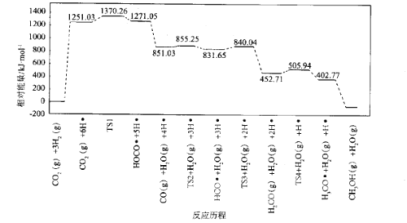
四个过渡态中对反应速率影响最大的是____,理由为____;该步骤的化学方程式为____。
【答案】2CO2+4H2O![]() 2CH3OH+3O2或2H2O
2CH3OH+3O2或2H2O![]() 2H2+O2、CO2+3H2
2H2+O2、CO2+3H2![]() CH3OH+H2O H2 -48.97 kJ· mo1-1 X 0.12 mol-1min-1 > b点比c点对应状态下反应物浓度大,体系温度高
CH3OH+H2O H2 -48.97 kJ· mo1-1 X 0.12 mol-1min-1 > b点比c点对应状态下反应物浓度大,体系温度高 ![]() TS1 该步反应的活化能(或能垒或需要吸收的能量)最大 CO2+6H=HOCO+5H或CO2+H=HOCO
TS1 该步反应的活化能(或能垒或需要吸收的能量)最大 CO2+6H=HOCO+5H或CO2+H=HOCO
【解析】
根据液态太阳燃料的合成示意图分析反应过程;根据盖斯定律计算热催化过程的ΔH,结合转化率图像选择合适的催化剂,并根据公式![]() 计算反应速率,根据三段式计算压强平衡常数,根据图像分析写出化学方程式。
计算反应速率,根据三段式计算压强平衡常数,根据图像分析写出化学方程式。
(1)由液态太阳燃料的合成示意图分析可知,排放在空气中的CO2与H2O电解产生的H2在太阳能的条件下发生反应生成CH3OH,反应的化学方程式为2CO2+4H2O![]() 2CH3OH+3O2或2H2O
2CH3OH+3O2或2H2O![]() 2H2+O2、CO2+3H2
2H2+O2、CO2+3H2![]() CH3OH+H2O,则太阳能出来储存在甲醇中,还储存在H2中,故答案为:2CO2+4H2O
CH3OH+H2O,则太阳能出来储存在甲醇中,还储存在H2中,故答案为:2CO2+4H2O![]() 2CH3OH+3O2或2H2O
2CH3OH+3O2或2H2O![]() 2H2+O2、CO2+3H2
2H2+O2、CO2+3H2![]() CH3OH+H2O;H2;
CH3OH+H2O;H2;
(2)根据题干信息,![]() (3×反应1-反应2)可得反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g),根据盖斯定律可得
(3×反应1-反应2)可得反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g),根据盖斯定律可得![]() ,故答案为:-48.97;
,故答案为:-48.97;
(3)①根据图像可知,相同温度时选用催化剂X时,CO2的转化率较高,故答案为:X;
②由图像,T1K时,a点对应容器在0~5 min内CO2的转化率为40%,则Δn(CO2)=1.0mol×40%=0.4mol,根据方程式CO2(g)+3H2(g)=CH3H(g)+H2O(g)可知,Δn(H2)=3Δn(CO2)=1.2mol,则平均反应速率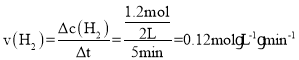 ,由于b点比c点对应状态下反应物浓度大,体系温度高,所以b点对应状态下反应物的有效碰撞几率b>c,故答案为:0.12 mol-1min-1;>;b点比c点对应状态下反应物浓度大,体系温度高;
,由于b点比c点对应状态下反应物浓度大,体系温度高,所以b点对应状态下反应物的有效碰撞几率b>c,故答案为:0.12 mol-1min-1;>;b点比c点对应状态下反应物浓度大,体系温度高;
③由图像可知,T2K时CO2的转化率为60%,即Δn(CO2)=1.0mol×60%=0.6mol,则可列三段式:
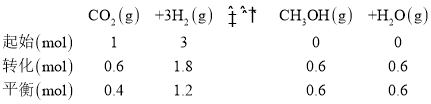
由阿伏加德罗定律PV=nRT可知,恒温恒容时,压强与物质的量成正比,因此反应后的总压强为0.7p,则该温度下反应的平衡常数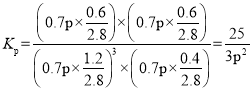 ,故答案为:
,故答案为:![]() ;
;
(4)由热催化反应的历程图分析可知,TS1步反应的活化能(或能垒或需要吸收的能量)最大,对反应速率的影响最大,反应方程式为CO2+6H=HOCO+5H或CO2+H=HOCO,故答案为:TS1;该步反应的活化能(或能垒或需要吸收的能量)最大;CO2+6H=HOCO+5H或CO2+H=HOCO。


科目:高中化学 来源: 题型:
【题目】在盛有1L0.1mol/LCuSO4溶液的大烧杯中,用锌、铜作电极,用导线连接形成原电池,当电极锌消耗3.25g时,试完成:
(1)写出电极反应式:负极__________________;正极____________。
(2)电极上析出铜的质量。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 。室温下用
。室温下用![]() 的
的![]() 滴定
滴定![]() 某一元酸
某一元酸![]() 的结果如图所示,下列说法中正确的是
的结果如图所示,下列说法中正确的是

A. ![]() 属于弱酸
属于弱酸
B. 整个过程中,![]() 点时水的电离程度最大
点时水的电离程度最大
C. ![]() 点对应液中
点对应液中![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.13 g13 C含有的中子数目为6 NA
B.常温下 ,I LpH =4的醋酸溶液所含离子总数为2 ×10-4NA
C.100 g质量分数为 98% 的磷酸中所含氧原子总数为4 NA
D.0.1 mol Fe 完全溶于稀硝酸,转移的电子数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。下列说法错误的是
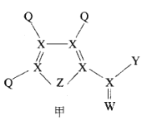
A.非金属性:X<Z<W
B.Q与W形成化合物的沸点高于Q与X形成化合物的沸点
C.化合物甲中除Q外,其它原子均满足8电子稳定结构
D.0.1 molL-1 最高价氧化物对应水化物的酸性:Y> Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(______、______)、稀硫酸、______、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。

(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为____________,在耳机中又由__________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的________极,电极反应式为_____________,发生了________反应;
③铜钉应该接电流表的________极,电极反应式为_____________,发生了_________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0. 100 0 mol·L-1 NaOH溶液滴定20. 00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是( )

A.点①所示溶液中:c(CH3COO-)+2c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.滴定过程中可能出现:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《梦溪笔谈》有记:馆阁新书净本有误书处,以雌黄涂之。在中国古代,雌黄(As2S3)经常用来修改错字,其结构如图所示。下列说法不正确的是( )
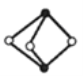
A.As、S原子的杂化方式均为sp3
B.AsH3的沸点比NH3的低
C.与As同周期且基态原子核外未成对电子数目相同的元素只有V
D.已知As2F2分子中各原子均满足8电子结构,分子中σ键和π键的个数比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物a、b、c在一定条件下的转化关系如图所示。下列说法正确的是
![]()
A. a中所有碳原子处于同一平面
B. b可用于萃取溴水中的溴
C. ①②均属于加成反应
D. 等物质的量的b、c分别完全燃烧,耗氧量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com