
【题目】化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。下列说法错误的是
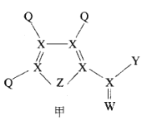
A.非金属性:X<Z<W
B.Q与W形成化合物的沸点高于Q与X形成化合物的沸点
C.化合物甲中除Q外,其它原子均满足8电子稳定结构
D.0.1 molL-1 最高价氧化物对应水化物的酸性:Y> Z
【答案】B
【解析】
由“Q、X、Z分列于三个不同周期”,可推出Q为H元素,X为第二周期元素,Z为第三周期元素;从甲的结构图中可以看出,X形成4个共价键,W形成2个共价键,Z形成2个共价键,则X最外层电子数为4,W最外层电子数为6,Z最外层电子数为6;从而得出X为C元素,W为O元素,Z为S元素。
由以上分析可知,Q、W、X、Y、Z分别为H、O、C、Cl、S。
A.因为酸性H2CO3<H2SO4,所以非金属性C<S,故非金属性:C<S<O,A正确;
B.H与O形成化合物可能为H2O或H2O2,沸点可能低于H与C形成化合物(如高聚物)的沸点,B错误;
C.化合物甲中含有H、C、O、S元素,除H外,其它原子均满足8电子稳定结构,C正确;
D.0.1 molL-1 最高价氧化物对应水化物的酸性:Cl> S,D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2=2H2O,负极电极反应式为: H2+CO32——2e—![]() H2O+CO2。则下列判断中正确的是
H2O+CO2。则下列判断中正确的是
A.放电时CO32—向负极移动
B.放电时CO32—向正极移动
C.正极反应: 4OH——4e—=2H2O+O2↑
D.当电池中生成1 mol水时,转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
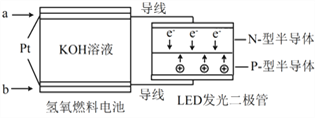
A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在![]() H、
H、![]() H、
H、![]() H、
H、![]() Mg、
Mg、![]() Mg和
Mg和![]() Cu中共有____种元素,_____种原子。
Cu中共有____种元素,_____种原子。
(2)有下列各组物质:A.O2和O3 B.12C和13C C.CH3—CH2—CH2—CH3和![]() D.
D.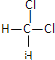 和
和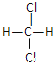 E.甲烷和庚烷。
E.甲烷和庚烷。
①_________组两物质互为同位素。
②__________组两物质互为同素异形体。
③_________组两物质属于同系物。
④_________组两物质互为同分异构体。
⑤_________组中两物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学依照如下图所示流程提取海带中的碘元素。
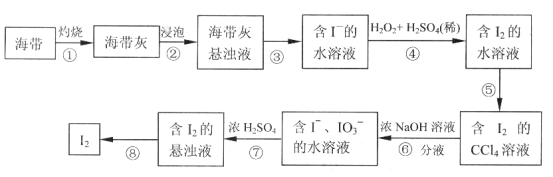
(1)步骤①中灼烧海带所用的仪器是__________(填序号)。
a.试管 b.坩埚 c.烧杯
(2)步骤④中用硫酸酸化的H2O2溶液将I-氧化成I2,反应的离子方程式是__________________。
(3)步骤⑤中采用的分离方法是___________________。
(4)经步骤⑤得到含I2的CCl4溶液后,继续采取步骤⑥⑦的目的是_______________。
(5)步骤⑦的反应中,当1molIO3-发生反应时,转移电子的物质的量是__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了解决能源的可再生及将CO2变废为宝等问题,科学家借鉴自然界的光合作用原理,通过“人工” 光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如下图所示。 请回答:
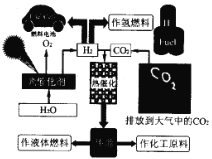
(1) 联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;______;在图示转化过程中,太阳能除了储存在甲醇中,还储存在_____中(填化学式)。
(2)图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。
已知:2H2(g)+O2(g)=2H2O (g)△H1= -483.6 kJmo1-1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1352.86 kJmol-1
△H =_____________。
(3)实验室对热催化反应进行模拟探究:一定温度下,向容积均为2 L 的恒容密闭容器中分别通入1.0 mol CO2(g)和3.0 mol H2(g), 在不同催化剂X、Y 的催化下发生反应。测得5 min时,CO2转化率与温度的变化关系如图所示。
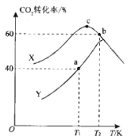
①该反应适宜选用的催化剂为__________(填“X'”或 “Y”)。
②T1K时,a点对应容器在0~5 min内的平均反应速率v(H2)=______;b、c点对应状态下反应物的有效碰撞几率b______c(填“>”“<”或“=”),原因为___________。
③T2K时,若反应前容器内的压强为p, 则该温度下反应的平衡常数KP=_________。 (KP为用分压表示的平衡常数)。
(4)我国化学家结合实验和计算机模拟结果,研究得出热催化反应的一种可能历程如图所示,其中自由基用“”标出,过渡态用TS表示。
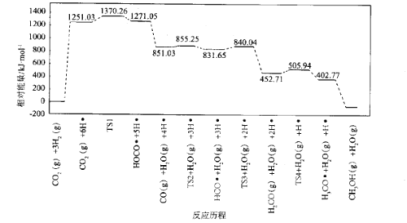
四个过渡态中对反应速率影响最大的是____,理由为____;该步骤的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
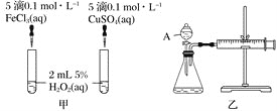
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
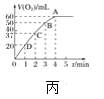
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸(C16H18O9)具有较广泛的抗菌、抗病毒、抗氧化作用,利用乙醚、60%乙醇浸泡杜仲干叶,得到提取液,进一步获得绿原酸粗产品的一种工艺流程如图,下列说法错误的是( )
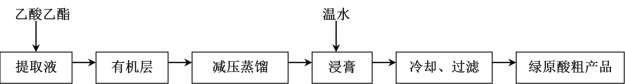
A.绿原酸在温水中的溶解度小于冷水中的溶解度
B.得到有机层的实验操作为萃取分液
C.减压蒸馏的目的防止温度过高,绿原酸变质
D.绿原酸粗产品可以通过重结晶进一步提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com