
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成0.05mol/Lb溶液的pH为1,d能使品红溶液褪色,e是液体,f的焰色反应为黄色,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )

A. 二元化合物沸点:e>d>c B. 氢化物的稳定性:Q>Y>X
C. 元素的非金属性:Y>X>W D. 原子半径的大小:Z>Q>Y
【答案】B
【解析】分析:自然界硬度最大的单质为金刚石,X为碳元素a为碳,根据b由W、Y、Q三种元素组成0.05mol/Lb溶液的pH为1,d能使品红溶液褪色,e为液体推出b为硫酸,d为SO2,那么c为CO2,e为H2O,f的焰色反应为黄色又可以和H2O反应,f为Na2O2,进一步推出g为O2,h为SO3,W、X、Y、Z、Q依次为H、C、O、Na、S元素。a、b、c、d、e、f、g、h依次为C、H2SO4、CO2、SO3、H2O、Na2O2、O2、SO3。
A. H2O中有氢键,熔沸点是三种化合物中最高的,CO2比SO3的相对分子质量小,所以熔沸点CO2<SO3,所以三者熔沸点顺序应该是H2O> SO3> CO2,故A正确;B. 元素的非金属性越强对应氢化物的稳定性越稳定,故氢化物的稳定性应该是O的稳定性最好,故B错误;C. H、C、O的非金属性强弱为O>C>H,故C正确;D.同周期随着原子序数增大原子半径依次减小,同主族从上到下半径依次增大,半径大小Na>S>O,故D正确;本题选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以1-氯丙烷为主要原料制1,2-丙二醇(CH3—CHOH—CH2OH)时,需要经过的反应依次为( )
A. 加成、消去、取代 B. 取代、加成、消去
C. 取代、消去、加成 D. 消去、加成、取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成0.05mol/Lb溶液的pH为1,d能使品红溶液褪色,e是液体,f的焰色反应为黄色,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )
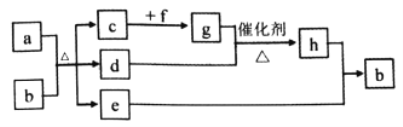
A. 二元化合物沸点:e>d>c B. 氢化物的稳定性:Q>Y>X
C. 元素的非金属性:Y>X>W D. 原子半径的大小:Z>Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O
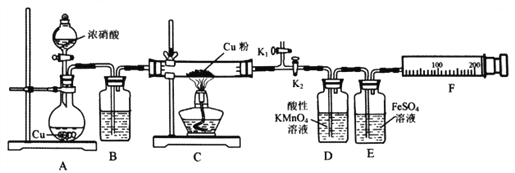
请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
C装置质量 | F装置气体的体积(已折算为标准状况) | ||
玻管质量 | Cu质量 | 反应后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )

A. 阴极与阳极产生的气体体积比为1:2 B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是重要的合金元素,可制作镍铬、镍铝等合金,镍也常用作有机加氢的催化剂及制取配合物。
(1)写出基态Cr的简化电子排布式__________,Cr中共有__________种不同能级的电子。
(2)Ni(CO)n与Fe(CO)5同属金属羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。
①Ni、C、O的电负性由大到小的顺序为____________________。
② Ni(CO)n分子中n=__________。
③已知Ni2+和Fe2+的离子半径分别为69pm和78pm,根据岩浆晶出规则熔融的NiO和FeO岩浆在冷却过程中,NiO更容易先结晶,试解释其原因____________________。
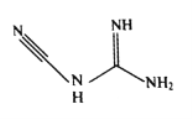
(3)检定镍、钴、铜钯等可用双氰胺,化学式C2H4N4,其结构简式如图所示。双氰胺分子中碳原子的杂化方式有__________,分子结构中键能最大的共价键是__________。
(4)镍的晶体结构、镍铝合金的晶胞如图所示。
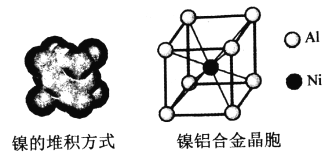
①镍晶体的堆积方式为__________。
②已知Al的第一、第二电离能分别为:l1=578kJ/mol,l2=1817kJ/mol,简述l2远大于l1的原因__________________________________________________。
③已知:镍铝合金密度为dg/cm3,NA代表阿伏伽德罗常数,则铝镍的核间距为__________ pm。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是

A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓盐酸中H3AsO3与SnCl2反应:SnCl2+H3AsO3+HCl(浓)→As+SnCl4+M,则正确的组合是( )
①H3AsO3被还原;②还原性:Cl->As;③M为电解质;④SnCl4是氧化产物;⑤每生成7.5gAs,还原剂失去的电子为0.3mol
A. ①③④⑤ B. ①④⑤ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列计算:
(1)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需KCl的质量为________g。
(2)在K2SO4和Al2(SO4)3的混合溶液中,测得Al3+的浓度为0.2molL﹣1,加入等体积0.6molL﹣1的BaCl2溶液恰好使SO42-完全沉淀,则混合溶液中K+的浓度为_____molL﹣1。
(3)某固态化合物X受热分解的反应为:X=A↑+B↑+C↑,在一定的温度和压强下测得反应生成的混合气体对氢气的相对密度为15,则X的摩尔质量是___________。
(4)标准状况下,将V L A气体(摩尔质量为M molL﹣1)溶于0.1L水(密度1g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度为____________molL﹣1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com