
【题目】(1)完全燃烧一定质量的无水乙醇,放出的热量为QkJ,为完全吸收生成的CO2,并使之生成正盐,消耗0.8mol/L NaOH溶液50mL,则燃烧1mol酒精放出的热量是_________________。
(2)白磷与氧可发生如下反应:P4+5O2=P4O10。
已知断裂下列化学键需要吸收的能量分别为:
P-P akJ·mol-1、P-O bkJ·mol-1、
P=O ckJ·mol-1、O=O dkJ·mol-1
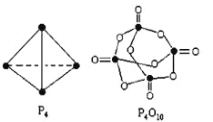
根据图示的分子结构和有关数据计算该反应的反应热__________________。
(3)现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=-19.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_______________。
【答案】
(1)100Q kJ;
(2)(6a+5d-4c-12b) kJ·mol-1
(3)FeO(s)+CO(g)=Fe(s)+CO2(g)ΔH=-11kJ·mol-1
【解析】
试题分析:(1)0.8mol/L的NaOH溶液50ml:n(NaOH)=0.05L×0.8mol/L=0.04mol,CO2与NaOH溶液反应:2NaOH+CO2═Na2CO3+H2O,则由CO2~2NaOH可知,n(CO2)=0.02mol,则n(C2H6O)=![]() ×n(CO2)=0.01mol,放出的热量为QkJ,所以1mol乙醇完全燃烧放出的热量为100QkJ,故答案为:100Q kJ;
×n(CO2)=0.01mol,放出的热量为QkJ,所以1mol乙醇完全燃烧放出的热量为100QkJ,故答案为:100Q kJ;
(2)各化学键键能为P-P a kJmol-1、P-O b kJmol-1、P=O c kJmol-1、O=O d kJmol-1。反应热△H=反应物总键能-生成物总键能,所以反应P4+5O2=P4O10的反应热△H=6akJmol-1+5dkJmol-1- (4ckJmol-1+12bkJmol-1)=(6a+5d-4c-12b)kJmol-1,故答案为:(6a+5d-4c-12b)kJmol-1;
(3)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol……①,
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ/mol……②,
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=-19.4kJ/mol……③,
①×3-②-③×2得:6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)
△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(-19.4kJ/mol)×2=-11kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如图:

回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是 .
(2)步骤②反应的离子方程式是 .
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 .
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”).

(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的 (填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是 (答出两点即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:下列说法不正确的是( )

A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.捕获剂所捕获的气体主要是CO
C.X可以是空气,且需过量
D.处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用下图所示装置进行实验。
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。装置④中产生NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c molL-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(4)滴定中使用的指示剂是 。
(5)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用石墨作阳极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。
回答下列问题:
(1)已知:T1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应的平衡常数值K1 =__________;该反应的活化能Ea (正)小于Ea (逆),则H_________0(填“小于”“等于”或“大于”)。

(2)T2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是___________(填曲线编号),平衡常数值K2 =__________;温度T2_________T1 (填“小于”“等于”或“大于”),判断理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的溶解平街曲线如阳所示。已知25℃其浓度积为2.8×10-9mol2/L2,下列说法不正的是( )

A.x数值为2×10-5 B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d 点变到a点 D.b点与d对应的的溶度积相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com