
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如图:

回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是 .
(2)步骤②反应的离子方程式是 .
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 .
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”).

(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的 (填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是 (答出两点即可).
【答案】(1)高铁酸钠(Na2FeO4)只能在碱性溶液中稳定存在,加入氢氧化钠固体可以调节溶液呈碱性。(2分)
(2)2Fe2++H2O2+2H+═2Fe3++2H2O(2分) (3)2Fe3++3ClO﹣+10OH﹣═2FeO42﹣+3Cl﹣+5H2O(2分)
(4)高(1分)(5)低(1分) 既能消毒杀菌又能净水(或无毒或方便保存等)(答出两点即可)
【解析】
试题分析:(1)步骤①是制备次氯酸钠的过程,加入氢氧化钠的目的是调节溶液显碱性,因为高铁酸钠(Na2FeO4)只能在碱性溶液中稳定存在,加入氢氧化钠固体可以调节溶液呈碱性。
(2)步骤②是加入过氧化氢在酸性溶液中氧化亚铁离子为铁离子的过程,反应的离子方程式为2Fe2+ +H2O2+2H+═2Fe3++2H2O。
(3)反应③是碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式为:2Fe3++3ClO﹣+10OH﹣═2FeO42﹣+3Cl﹣+5H2O。
(4)依据高铁酸钠在碱性溶液中稳定存在,发生的反应为:FeO42-+3e-+4H2OFe(OH)3+5OH-,污水的PH越高平衡逆向进行,PH越小平衡正向进行,依据图象分析Ⅱ先达到平衡需要的时间短,反应速率快,说明污水PH小,曲线I比曲线II对应的污水的PH高。
(5)FeO42-+3e-+4H2OFe(OH)3+5OH-,单位质量得到电子3÷166==0.018,Cl2+2e-=2Cl-,单位质量得到电子2÷71=0.028,所以Na2FeO4的消毒效率比氯气低,高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用,所以既能消毒杀菌又能净水。


科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的化合物的叙述正确的是
A. 蛋白质分子中的N主要存在于氨基中
B. 糖原的最终代谢产物是葡萄糖
C. 组成ATP、DNA、RNA的元素种类完全相同
D. 脂肪分子中含H比糖类多,是主要的能源物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如图(左)所示:原电池工作过程中OH-的作用是_______________;负极电极反应式为:_____________。若电路中转移电子数为0.8NA,左侧溶液中pH________(填“增大”,“减小”,”不变”)(忽略溶液体积的变化),右侧的OH-物质的量变化量为_________。
(2)CH4与H2O在隔绝空气、高温和催化剂条件下反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=m kJ·mol—1
CO(g)+3H2(g) ΔH=m kJ·mol—1
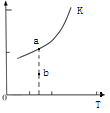
则反应的平衡常数表达式K=______________,K的大小与温度(T)的关系如上图(右)中曲线所示,则m__________0(填“>”“=”或“<”);改变某一条件,使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,则CH4的转化率___________(填“增大”、“减小”、“不变”或“不确定”),反应的焓变(△H)将_______________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向2 L恒容密闭容器中充入1 mol PCl5,发生反应:PCl5(g) ![]() PCl3(g)+Cl2(g) ,一段时间后达到平衡。部分数据见下表,下列说法正确的是
PCl3(g)+Cl2(g) ,一段时间后达到平衡。部分数据见下表,下列说法正确的是
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 2 | 0. 2 |
A.0~50 s内平均速率v(PCl3)= 0. 0032 mol·L-1·s-1
B.其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1mol PCl5、0. 2 mol PCl3 和0. 2 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2 mol PCl3 、2 mol Cl2,达到平衡时PCl3 的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:MgSO4(s) + CO(g)![]() MgO(s)+CO2(g)+SO2(g) ΔH>0。在恒容密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0。在恒容密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,y随x变化趋势合理的是
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
2H2(g) + O2(g)=2H2O(l) △H=-571.6 kJ/mol
C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol
(1)氢气的燃烧热是__________________。
(2)已知:H2O(l)=H2O(g ) △H=+44.0 kJ/mol写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:_____________________。
(3)实验测得H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2791.6 kJ,计算混合气体中H2和C3H8的体积比是________________。
(4)C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol当反应中转移10mol电子时,燃烧的丙烷(C3H8)的质量是________ g,生成的CO2在标准状况下的体积是_________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硫酸既表现出强氧化性,又表现出酸性的是( )
A.稀硫酸与锌粒反应生成气体
B.浓硫酸使铁、铝钝化
C.浓硫酸与铜反应加热反应产生SO2
D.浓硫酸和木炭在加热条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧一定质量的无水乙醇,放出的热量为QkJ,为完全吸收生成的CO2,并使之生成正盐,消耗0.8mol/L NaOH溶液50mL,则燃烧1mol酒精放出的热量是_________________。
(2)白磷与氧可发生如下反应:P4+5O2=P4O10。
已知断裂下列化学键需要吸收的能量分别为:
P-P akJ·mol-1、P-O bkJ·mol-1、
P=O ckJ·mol-1、O=O dkJ·mol-1
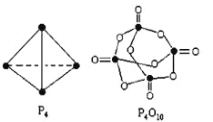
根据图示的分子结构和有关数据计算该反应的反应热__________________。
(3)现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=-19.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com