
【题目】已知下列热化学方程式:
2H2(g) + O2(g)=2H2O(l) △H=-571.6 kJ/mol
C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol
(1)氢气的燃烧热是__________________。
(2)已知:H2O(l)=H2O(g ) △H=+44.0 kJ/mol写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:_____________________。
(3)实验测得H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2791.6 kJ,计算混合气体中H2和C3H8的体积比是________________。
(4)C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol当反应中转移10mol电子时,燃烧的丙烷(C3H8)的质量是________ g,生成的CO2在标准状况下的体积是_________ L。
【答案】
(1)285.8kJ/mol
(2)C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(l) △H=-2220.0 kJ/mol
(3)2:1;(4)22 g;33.6L
【解析】
试题分析: (1)根据燃烧热的概念,通常在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,则1mol氢气燃烧放出的热量为![]() ×571.6 kJ=285.8kJ,因此氢气的燃烧热是285.8kJ/mol,故答案为:285.8kJ/mol;
×571.6 kJ=285.8kJ,因此氢气的燃烧热是285.8kJ/mol,故答案为:285.8kJ/mol;
(2)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(g);△H=-2044.0kJ/mol
②H2O(1)=H2O(g);△H=+44.0kJ/mol
由盖斯定律可知,①-②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220.0kJ/mol,
故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220.0kJ/mol;
(3)由热化学方程式可知,氢气的燃烧热为285.8kJ/mol,丙烷的燃烧热为2220.0kJ/mol,H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2791.6kJ,则混合气体中,H2和C3H8的物质的量分别为:xmol和(3-x)mol,所以体积比为285.8x+2220(3-x)=2791.6,x=2 mol,所以物质的量之比为:2mol:(3-2)mol=2:1,故答案为:2:1;
(4)C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol,反应中5molO2转移电子5×4=20mol,
当反应中转移10mol电子时,燃烧的丙烷(C3H8)的物质的量为0.5mol,质量为0.5mol×44g/mol=22g, 生成的CO2在标准状况下的体积为![]() mol×22.4L/mol=33.6L,故答案为:22 g;33.6L。
mol×22.4L/mol=33.6L,故答案为:22 g;33.6L。


科目:高中化学 来源: 题型:
【题目】t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应3A(g)+B(g) ![]() xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请填写下列空白:
xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均反应速率为 。
(2)x= 。
(3)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol。
(4)保持温度和体积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是 (填字母)。
A.均减半 B.均加倍 C.均增加0.4mol D.均减小0.4mol
(5)如果上述反应在相同温度和容积的容器中进行,起始加入3molA和3molB,达到平衡时A的体积分数为a%。其它条件不变时,按下列配比作为起始物质,平衡时A的体积分数大于a%的是 (填字母)。
A.2molC B.1molA、3molB和4molC
C.1molB和4molC D.6molA和2molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是

A.该装置可以将光能转化为电能,同时也能转化为化学能
B.TiO2电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如图:

回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是 .
(2)步骤②反应的离子方程式是 .
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 .
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”).

(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的 (填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是 (答出两点即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:
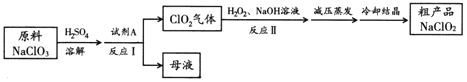
已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(3) 反应Ⅱ的离子方程式为 。
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是_________________。
(5) NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
(6) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2。若处理含NaCN 4×10-5mol ·L-1的废水 1000L,至少需要ClO2 的质量为___________g。
(7) ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于“碳是生命的核心元素”,“没有碳,就没有生命”的叙述,错误的是( )
A. 碳元素在生物体内含量最多
B. 组成细胞的重要有机物都含有碳元素
C. 组成蛋白质的氨基酸是以若干个相连的碳原子构成的碳链为基本骨架
D. 组成多糖的单糖是以若干个相连的碳原子构成的碳链为基本骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
(1)写出反应①屮氧化还原反应的离子方程式___________________。
(2)向反应①后的溶液中加浓氨水的目的是_________________。
(3)写出反应②的化学方程式_________________;反应②常用冰水控制温度在0℃左右.其可能原因是(写出两种):
①________________;②________________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加人适量蒸馏水和过量的b gKI晶体,再滴人少量2 mol L-1H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加人几滴淀粉溶液。
第三步:逐滴加入浓度为c mol L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。已知:I2+2S2O32- =2I-+S4O62-。
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能__________(填“不受影响”“偏低”或“偏高”),原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用石墨作阳极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com