
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:
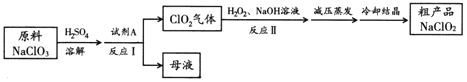
已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(3) 反应Ⅱ的离子方程式为 。
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是_________________。
(5) NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
(6) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2。若处理含NaCN 4×10-5mol ·L-1的废水 1000L,至少需要ClO2 的质量为___________g。
(7) ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
【答案】(1)a(2分) (2)ac(2分)
(3)2ClO2 + H2O2 + 2OH- === 2ClO2- + 2H2O + O2(2分)
(4)在较低温度蒸发浓缩,可防止温度过高NaClO2分解(2分)
(5)相同(2分)(6)2.7(2分)
(7)5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O(2分)
【解析】
试题分析:(1)结合流程图可知,反应Ι为ClO3-到ClO2,氯元素化合价降低,需加入还原剂A发生氧化还原反应,b、c均为氧化剂,所以试剂A选择a;
(2)反应Ⅰ进行过程中需不断鼓入空气,使二氧化氯的含量保持低浓度,且反应I后的母液中含有硫酸钠,因为二氧化氯在碱性条件下稳定存在,所以加入NaOH应过量,答案选ac。
(3)由流程图最后的产品为NaClO2可知,该过程中氯元素被还原,所以反应II的离子方程式为:2ClO2 + H2O2 + 2OH- === 2ClO2- + 2H2O + O2;
(4)因为压强越大,物质的沸点越高,所以反应Ⅱ结束后采用“减压蒸发”操作的原因是在较低温度蒸发浓缩,可防止温度过高NaClO2分解。
(5)NaClO2变质可分解为NaClO3和NaCl,Cl元素从+3价变为+5价和-1价,反应为3NaClO2=2NaClO3+ NaCl,NaClO2试样与足量FeSO4溶液反应3ClO2- + 12Fe2+ + 6H2O = 4Fe(OH)3↓ + 3Cl- + 8Fe3+,最终得到Cl元素由+3价变为-1价,所以NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同
(6)由题给条件反应的方程式为:2ClO2 + 2NaCN = 2NaCl + N2 + 2CO2 ,n(NaCN) = 4 × 10-5 × 1000 = 0.04 mol,由化学方程式可知n(ClO2) = 0.04mol ,m(ClO2) = 0.04 × 67.5 = 2.7g。
(7)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。则该反应的化学方程式为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5molL﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO3﹣ | CO32﹣ | SiO32﹣ | SO42﹣ |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号K] | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是;
(2)实验Ⅰ中生成气体的离子方程式为;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
阴离子 | NO3﹣ | CO32﹣ | SiO32﹣ | SO42﹣ |
c/molL﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现下列变化的有机反应的类型,不正确的是( )
A. CH3CH3→CH3CH2Cl 取代反应
B. CH2=CH2→CH2BrCH2Br 加成反应
C. CH2=CH2→CH3CH2OH 取代反应
D. CH≡CH→CHBr=CHBr 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向2 L恒容密闭容器中充入1 mol PCl5,发生反应:PCl5(g) ![]() PCl3(g)+Cl2(g) ,一段时间后达到平衡。部分数据见下表,下列说法正确的是
PCl3(g)+Cl2(g) ,一段时间后达到平衡。部分数据见下表,下列说法正确的是
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 2 | 0. 2 |
A.0~50 s内平均速率v(PCl3)= 0. 0032 mol·L-1·s-1
B.其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1mol PCl5、0. 2 mol PCl3 和0. 2 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2 mol PCl3 、2 mol Cl2,达到平衡时PCl3 的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
2H2(g) + O2(g)=2H2O(l) △H=-571.6 kJ/mol
C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol
(1)氢气的燃烧热是__________________。
(2)已知:H2O(l)=H2O(g ) △H=+44.0 kJ/mol写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:_____________________。
(3)实验测得H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2791.6 kJ,计算混合气体中H2和C3H8的体积比是________________。
(4)C3H8(g) + 5O2(g)=3CO2(g) +4 H2O(g ) △H=-2044.0 kJ/mol当反应中转移10mol电子时,燃烧的丙烷(C3H8)的质量是________ g,生成的CO2在标准状况下的体积是_________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是 ( )
A.三氯蔗糖(C12H19Cl3O8)属于天然的糖类甜味剂
B.未成熟的青苹果肉遇碘酒变蓝色,成熟苹果的汁能发生银镜反应
C.利用盐析的方法可以用来分离、提纯蛋白质
D.酚醛树脂、合成橡胶、有机玻璃都属于有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL相同浓度的盐酸(如下图),同时将两个侧管中的物质 全部倒入各自的试管中,下列叙述正确的是

A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2molL-1
C.若最终两气球体积不同,则一定有c(HCI)≤lmolL-1
D.最终两溶液中Na+、C1-的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域.其制备反应原理为:Al2O3+N2+3C═2AlN+3CO.制备过程中,原料配比不当或反应不完全等因素都会造成产品中含有碳或Al2O3等杂质.为测定产品中AlN的质量分数,某同学按如图1装置进行相关实验.可选用的化学试剂为:mg氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精.回答下列问题:

(1)组装完实验装置,使用前第一步应该
(2)图1(B)中试剂最好选用 (填序号):
①煤油 ②医用酒精 ③水
已知A 中有NaAlO2生成,并放出有刺激性气味气体,写出A中发生反应的离子方程式 .
(3)读取C(量筒)中液体体积时,应注意下列问题,错误的是 (填序号)
a.C中液面不再上升时立即读数
b.上下移动C,使之液面与B中液面相平
c.A中不再有气泡逸出
d.视线与凹液面最低处相平
(4)mg氮化铝与足量NaOH饱和溶液反应,实验结束后,C中收集到液体的体积为VL(已折算成标准状况),则AlN样品的纯度为 (写计算表达式).
(5)上述实验方案,可能因气体体积测量不准,导致误差较大.有人建议改用下列A、B两个装置中的一种(在通风橱内进行),只需进行简单而又必要的数据测写,用差量法就可比较准确确定样品中AlN的质量分数.较合理的装置是: (填代号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com